Изменение потенциалов отдельных электродов
Цель работы:
§ Составить полуэлементы и вычислить на основании экспериментальных данных потенциалы заданных электродов.
§ Рассчитать электродные потенциалы по уравнению Нернста и сравнить их значения с вычисленными на основании опытных данных.
§ Изучить влияние концентрации электролита и природы электрода на значение электродного потенциала.
Порядок выполнения работы.
В основе определения потенциалов электродов лежит измерение ЭДС гальванических элементов, состоящих из электродов, потенциалы которых нас интересуют, и электрода сравнения, например, хлорсеребряного
(е0Cl-|AgCl|Ag = + 0,222B) .
Для экспериментального определения электродных потенциалов составляют следующие гальванические элементы:
Ag | AgCl | KCl || CuSO4 | Cu,
С1
Zn | ZnSO4 || KCl | AgCl | Ag.
С2
Хлорсеребряный электрод по отношению к медному является отрицательным, по отношению к цинковому – положительным.
ЭДС составленных элементов (Ех) измеряют на установке, схема которой приведена на рис. 2.
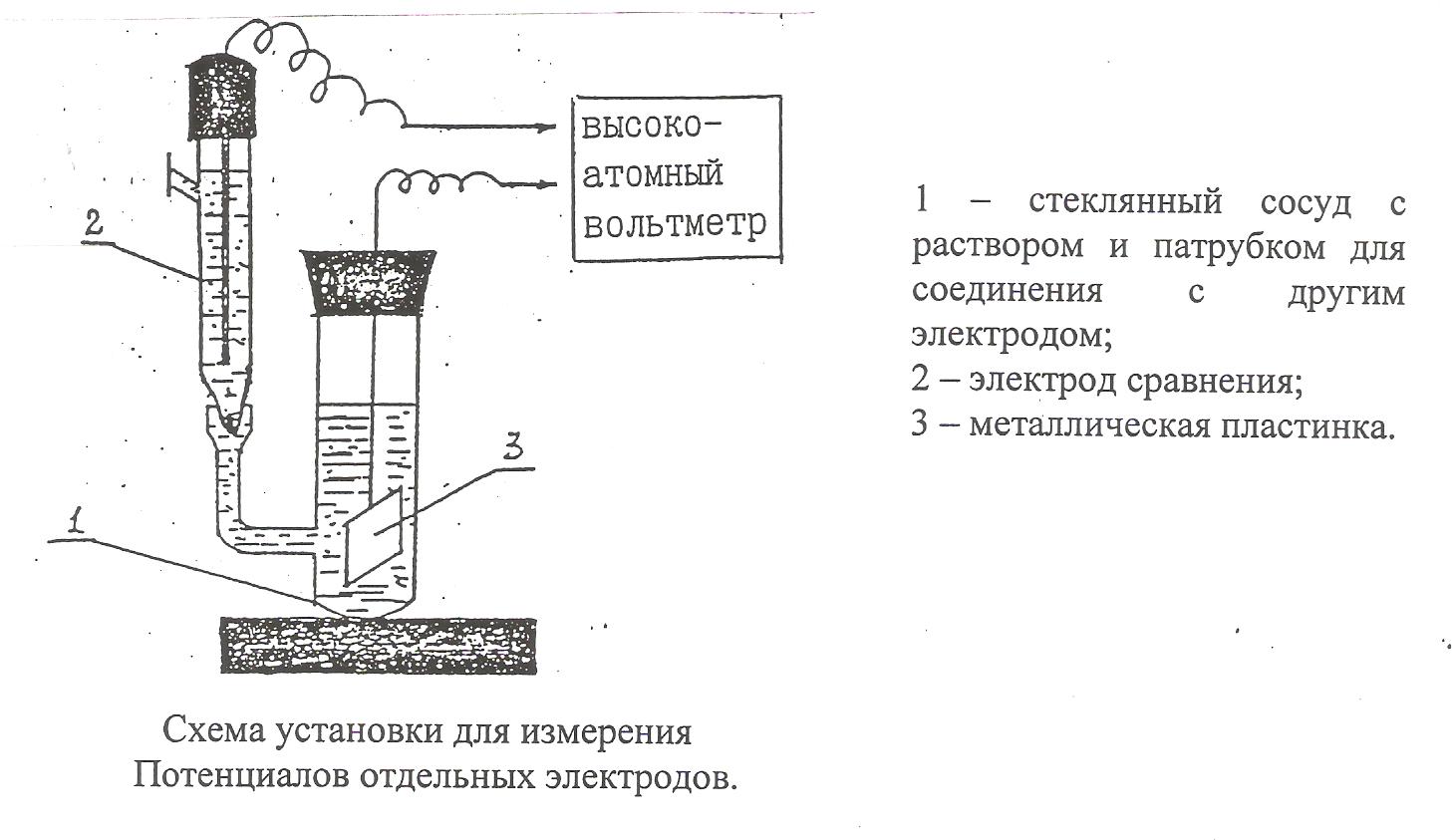 1 – стеклянный сосуд с раствором и патрубком для соединения с другим электродом;
1 – стеклянный сосуд с раствором и патрубком для соединения с другим электродом;
2 – электрод сравнения;
Металлическая пластинка.
Схема установки для измерения
Потенциалов отдельных электродов.
Зная потенциал стандартного электрода Сl- | AgCl | Ag и измеренную ЭДС, вычисляют потенциал исследуемого электрода.
Для цинк – хлорсеребряного элемента:
Ех = eCl-|AgCl|Ag - eZn2+|Zn ,
Для хлорсеребряно – медного элемента:
Ех = eCu2+|Cu - eCl-|AgCl|Ag .
Откуда соответственно
eZn2+|Zn = eCl-|AgCl |Ag – Ex ,
eCu2+|Cu = eCl-|AgCl |Ag + Ex .
Для сопоставления потенциалы этих же электродов рассчитывают по уравнению Нернста:
Т
е = е0 + 2·10-4 · lnai
z
где аi – активность потенциалопределяющего катиона.
Указанную последовательность определений выполняют, проводя опыты с растворами электролитов разных концентраций.
Полученные результаты заносят в таблицу 2.
Таблица 2.
| № изме- рения | Гальванический элемент | Кон- цент- трация моль/л | Еизм., В | еизм., В | етеор., В | Относит. ошиб.из- мерения, 0/0 |
| Zn|ZnSO4||KCl|AgCl|Ag Ag|AgCl|KCl||CuSO4|Cu |
Лабораторная работа № 3.
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОЙ КИСЛОТЫ ПОТЕНЦИОМЕТРИЧЕСКИМ ТИТРОВАНИЕМ
Показатель константы диссоциации слабой кислоты находят по измерению рН раствора, в котором кислота на 50% нейтрализована основанием. Требуемое количество основания определяют при помощи потенциометрического титрования, сущность которого заключается в том, что конечную точку нейтрализации находят по резкому изменению потенциала индикаторного электрода.
В качестве индикаторного электрода в данной работе берут стеклянный электрод. Электродом сравнения служит хлорсеребряный.
Оборудование:потенциометр, мешалка, электролитическая ячейка.
Реактивы: раствор уксусной кислоты, раствор гидроксида натрия 0,1 моль/л.
Ход работы.
В электролитическую ячейку наливают 20 мл раствора уксусной кислоты и титруют 0,1М раствором NaOH. Концентрация NaOH должна быть больше концентрации кислоты, чтобы не сильно разбавлять раствор кислоты. После добавления каждой порции щёлочи раствор помешивают и через 2-3 мин. при помощи потенциометра измеряют ЭДС. Измерения проводят по шкале «+мв». Сначала 2-3 раза добавляют 0,2 мл, а затем по 0,1 мл. NaOH до резкого скачка ЭДС. После скачка ЭДС приливают последовательно ещё 0,2; 0,3; 0,5 мл NaOH. Результаты титрования заносят в таблицу.
| № опыта | Объём щёлочи, мл | ΔV, мл | Е, мВ | ∆Е, мВ | ∆Е/∆V |
| 1. 2. 3. . . n |
По полученным данным строят график. На ординате откладывают соотношение ∆Е/ΔV, а на абсциссе количество миллилитров, добавленной NaOH. Пик на кривой соответствует точке эквивалентности.
Точку эквивалентности можно также найти, если после каждой порции NaOH измерить рН и построить график в координатах ΔрН/ΔV и V. Количество миллилитров NaOH, необходимое для полной нейтрализации данной порции кислоты, будет также соответствовать пику на кривой.
Для определения константы диссоциации следует взять новую порцию такого же объема кислоты, нейтрализовать её половинным количеством NaOH и измерить рН полученного раствора.
В отчёте должны быть приведены таблица результатов, график, расчёты константы диссоциации и исходной концентрации кислоты.
Лабораторная работа №4.
