Потенциалов отдельных электродов
| Гальванические цепи | Еоп, В | Етеор, В | eоп, В |
| Cu|CuSO4(1 M)| KCl |ZnSO4(1 M)|Zn | - | ||
| Ag|AgCl, KCl| KCl | ZnSO4 (1 M)|Zn | - | eZn = | |
| Cu|CuSO4 (1 M)| KCl | KCl, AgCl|Ag | - | eCu = | |
| Cu|CuSO4 (1 M)| KCl | CuSO4 (0,01М)|Cu | - | ||
Pt| 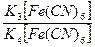 | |KCl, AgCl|Ag | |KCl, AgCl|Ag | - | eов = | |
| Pt| почва| | KCl, AgCl|Ag | - | eов = |
Расчет ЭДС гальванических цепей и электродных потенциалов электродов, используемых в лабораторной работе.
1. Вычислить ЭДС гальванического элемента Даниеля-Якоби теоретически (Етеор):
E = eCu - eZn
Для вычисления потенциалов используют уравнение Нернста, учитывая, что в 1 М растворе сульфатов меди и цинка fa,CuSO4 = fa,ZnSO4.
Нормальный потенциал медного электрода e0Cu = 0,34 В.
Нормальный потенциал цинкового элетрода e0Zn = -0,76 В.
Поскольку fa,CuSO4 = fa,ZnSO4, теоретическая ЭДС элемента Даниеля-Якоби будет равна
Етеор = e0Cu - e0Zn
Вычисленную теоретическую величину ЭДС записывают в соответствующую графу табл. 1 и сравнивают её с ЭДС, найденной опытным путем. Эти величины должны отличаться не более, чем на 0,05 В.
2. Проверить правильность найденных значений электродных потенциалов медного и цинкового электродов, используя их опытные значения при вычислении ЭДС медно-цинкового гальванического элемента по уравнению
E = eCu - eZn
Сравнивают полученную величину с найденной величиной ЭДС опытным путем в первом задании. Если эти величины отличаются не более чем на 0,01 В, работа выполнена правильно.
3. Проверить правильность измерения ЭДС концентрационной цепи, вычислив теоретически ЭДС медного концентрационного элемента по уравнению
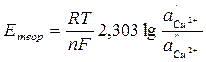
где – 2,303 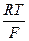 = 0,0577 + 0,0002(t –18) для любой температуры t, n – валентность ионов Cu2+; a’- активность ионов меди в 1 М растворе сульфата меди; f’- коэффициент активности ионов меди 1 М растворе сульфата меди, равный 0,041; a’’ – активность ионов меди в 0,01 М растворе сульфата меди; f’’ – коэффициент активности ионов меди в 0,01 М растворе сульфата меди, равный 0,41.
= 0,0577 + 0,0002(t –18) для любой температуры t, n – валентность ионов Cu2+; a’- активность ионов меди в 1 М растворе сульфата меди; f’- коэффициент активности ионов меди 1 М растворе сульфата меди, равный 0,041; a’’ – активность ионов меди в 0,01 М растворе сульфата меди; f’’ – коэффициент активности ионов меди в 0,01 М растворе сульфата меди, равный 0,41.
Вычисленную величину Етеор сравнивают с найденной опытным путем Еоп и, если они отличаются не более чем на 0,01 В, записывают результаты в табл. 1.
4. Рассчитать активность окисленной формы Fe, если известна величина окислительно-восстановительного потенциала (из задания 5 или 6 по указанию преподавателя), активность восстановленной формы Fe равна 0,1, нормальный окислительно-восстановительный потенциал e0ов для данных окислителя и восстановителя равен +0,771 В.
ВЫЧИСЛЕНИЯ:
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Что такое электрод? Примеры.
2. Электроды первого рода. Уравнение Нернста для электродов первого рода.
3. Электроды второго рода. Уравнение Нернста для электродов второго рода.
4. Окислительно- восстановительные электроды и цепи. Уравнение Нернста-Петерса.
5. Гальванические элементы (цепи). Концентрационные цепи (примеры).
ЛАБОРАТОРНАЯ РАБОТА № 2.
