Взаимодействие основных оксидов с кислотными оксидами.
Например:
MgO + CO2 = MgCO3
7) Квантово-механическая модель атома: уравнения де Бройля и Шредингера, принцип неопределенности Гейзенберга, атомная орбиталь, квантовые числа.
Согласно уравнению де Бройля (одному из основных уравнений квантовой механики)*,
лямбда=h/(mv), (1.6)
т. е. частице с массой т, движущейся со скоростью v, соответствует волна длиной лямбда; h — постоянная Планка.
В простейшем случае уравнение Шредингера может быть записано в виде
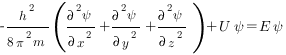
где h — постоянная Планка; m — масса частицы; U — потенциальная энергия; Е — полная энергия; х, у, z — координаты; Ψ — волновая функция.
Решая уравнение Шредингера, находят волновую функцию Ψ=f(x, y, z).
Cогласно принципу неопределенности Гейзенберга, невозможно определить траекторию движения электронов в атоме.
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90%-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90%-ой плотности заряда электрона (как волны).
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
| Квантовое число | Символ | Описание | Значения |
| Главное | n | Энергетический уровень орбитали | Положительные целые числа:1, 2, 3... |
| Орбитальное | l | Форма орбитали | Целые числа от 0 до n-1 |
| Квантовое | m | Ориентация | Целые числа от -l до +l |
| Спиновое | ms | Спин электрона | +½ и -½ |
8) Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда).
Принцип минимальной энергии гласит, что электроны заполняют орбитали в порядке возрастания их энергии.
Принцип Паули гласит, что в атоме нет и не может быть даже двух электронов с одинаковым набором квантовых чисел. Принцип Паули является следствием фундаментального в квантовой механике различия между частицами с целым и полуцелым спином (ms — целое или дробное). Этот принцип в данной формулировке как раз и характеризует свойства частиц с полуцелым спином.
Правило Хунда (Гунда) требует, чтобы заполнение электронами орбиталей происходило так, чтобы суммарный спин системы был максимальным. Правило Хунда действует в рамках Принципа минимальной энергии и Принципа Паули, т.е. выполняется только при выполнении этих Принципов.
правило Клечковского . Правило гласит: энергия атомных орбиталей возрастает с ростом суммы n+l. При равном значении суммы энергия больше у орбитали с большим значением n.
9)Периодический закон Д.И. Менделеева. Периодическая таблица (периоды и группы).
Менделеев считал, что основной характеристикой элементов являютсяих атомные веса, и в 1869 г. впервые сформулировал периодический закон:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные (А) и побочные подгруппы (Б).
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
Период – химические элементы, расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
10) Химическая связь: понятие, параметры (энергия связи, длина связи, валентный угол), потенциал ионизации, сродство к электрону, электроотрицательность.
Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
1) Длиной связи – межъядерным расстоянием между двумя химически связанными атомами.
2) Валентным углом – углом между воображаемыми линиями, проходящими через центры химически связанных атомов.
3) Энергией связи – количеством энергии, затрачиваемой на ее разрыв в газообразном состоянии.
4) Кратностью связи – числом электронных пар, посредством которых осуществляется химическая связь между атомами.
Способности атома данного элемента оттягивать к себе электронную плотность в молекуле получило название электроотрицательность.
Сродство атома к электрону Ae - способность атомов присоединять добавочный электрон и превращаться в отрицательный ион.
Энергия (потенциал) ионизации атома Ei- минимальная энергия, необходимая для удаления электрона из атома на бесконечность в соответствии с уравнением.
11) Типы химической связи: ионная, ковалентная (типы ковалентной связи, полярность), координационная, металлическая, водородная.
Ионная связь — это электростатическое взаимодействие между ионами с зарядами противоположного знака.Валентность элементов в соединениях с ионными связями очень часто характеризуют степенью окисления, которая, в свою очередь, соответствует величине заряда иона элемента в данном соединении.
Cвязь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам, называетсяковалентной.
Водородная связь. Само название этого типа связи подчеркивает, что в ее образовании принимает участие атом водорода. Водородные связи могут образовываться в тех случаях, когда атом водорода связан с электроотрицательным атомом, который смещает на себя электронное облако, создавая тем самым положительный заряд d + на водороде.
Металлическая связь существует в металлах. Она возникает за счет взаимодействия относительно свободных валентных электронов с ионами металлов. Вещества с металлической связью твердые, только ртуть жидкая.
Ковалентная связь, образующаяся за счет пары электронов одного из атомов, т.е. по донорно-акцепторному механизму, называется дoнорно-акцeпторной.
Например, такая связь образуется между атомом азота в молекуле метиламина CH3NH2 и протоном H+ кислоты HCl.
12) Термодинамические системы: открытые, закрытые, изолированные; гомогенные, гетерогенные. Параметры системы.
Химическая термодинамика – это раздел физической химии, которая изучает превращения различных видов энергии при химических реакциях, процессах растворения, кристаллизации.
Системы, которые могут обмениваться с окружающей средой и энергией и веществом называются открытыми. Системы, которые обмениваются только энергией, называются закрытыми.
Различают также гомогенные системы, состоящие из одной фазы и гетерогенные, состоящие из нескольких фаз. Реакции, которые протекают на границе раздела фаз – гетерогенные.
Если между средой и системой отсутствует и тепло- и масcообмен – это изолированная система.
Термодинамические параметры:
Параметры состояния
Термодинамические параметры - температура, плотность, давление, объем, удельное электрическое сопротивление и другие физические величины:
- однозначно определяющие термодинамическое состояние системы;
- не учитывающие молекулярное строение тел; и
- описывающие их макроскопическое строение.
13) Функции состояния системы: внутренняя энергия, энтальпия, энтропия, химический потенциал, изобарно- и изохорно-изотермический потенциал. Изобарные, изохорные, изотермические процессы.
Поведение всякой термодинамической системы в общем случае определяется одновременным действием двух факторов – энтальпийного, отражающего стремление системы к минимуму тепловой энергии, и энтропийного, отражающего противоположную тенденцию – стремление системы к максимальной неупорядоченности.
Функция 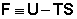 есть изохорно-изотермический потенциал (свободная энергия Гельмгольца), определяющий направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изохорно-изотермических условиях.
есть изохорно-изотермический потенциал (свободная энергия Гельмгольца), определяющий направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изохорно-изотермических условиях.
Закрытую систему, находящуюся в изобарно-изотермических условиях, характеризуетизобарно-изотермический потенциал G:
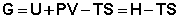
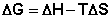
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ
термодинамич. функция состояния, определяющая изменение потенциалов термодинамических при изменении числа ч-ц в системе и необходимая для описания св-в открытых систем (с перем. числом ч-ц).
изохорный, (v= const) происходящий при постоянном объеме газа;
изобарный, (р = const) происходящий при постоянном давлении;
изотермический, (Т = const) происходящий при постоянной температуре;
14) Первое (закон сохранения энергии) и второе начало термодинамики.
ПЕРВОЕ НАЧАЛОТЕРМОДИНАМИКИ, один из осн. законов термодинамики; является законом сохранения энергии для систем, в к-рых существ, значение имеют тепловые процессы (поглощение или выделение тепла). Согласно первому началу термодинамики, термодинамич. система (напр.,пар в тепловой машине) может совершать работу только за счет своей внутр. энергии или к.-л. внеш. источника энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, к-рый совершал бы работу, не черпая энергию из нек-рого источника.
Первое начало термодинамики вводит представление о внутренней энергии системы как ф-ции состояния. При сообщении системе нек-рого кол-ва теплоты Q происходит изменение внутр. энергии системы DU и система совершает работу А:
DU = Q + А
ВТОРОЕ НАЧАЛОТЕРМОДИНАМИКИ, устанавливает существование энтропии как ф-ции состояния макроскопич. системы и вводит понятие абс. термодинамич. т-ры. Утверждает, что все процессы, протекающие с конечной скоростью, в принципе необратимы, и дает термодинамич. критерии для определения направленности процессов. Вместе с первым началом термодинамики - основа классич., или феноменологич., термодинамики, к-рую можно рассматривать как развитую систему следствий этих двух начал.
15)Тепловой эффект реакции: экзо- и эндотермические реакции; закон Гесса; (стандартная) теплота образования вещества.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты.
Эндотерми́ческие реа́кции (от др.-греч. ἔνδον — внутри и θέρμη — тепло) — химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения ( 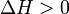 ,
, 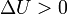 ), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.
), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.
К эндотермическим реакциям относятся:
§ реакции восстановления металлов из оксидов,
§ электролиза (поглощается электрическая энергия),
§ электролитической диссоциации (например, растворение солей в воде),
§ ионизации,
§ фотосинтеза.
Пользуясь табличными значениями 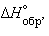
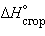 и
и 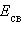 , можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
, можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
16) Скорость реакции и факторы, влияющие на нее. Гомогенные и гетерогенные реакции. Закон действующих масс. Константа скорости реакции. Порядок и молекулярность реакции. Правило Вант-Гоффа.
Скорость химической реакции можно выразить как изменение количества вещества (n, по модулю) в единицу времени (t) – сравните скорость движущегося тела в физике как изменение координат в единицу времени: υ = Δx/Δt. Чтобы скорость не зависела от объема сосуда, в котором протекает реакция, делим выражение на объем реагирующих веществ (v), т.е. получаем изменение количества вещества в единицу времени в единице объема, или изменение концентрации одного из веществ в единицу времени:
n2 – n1 Δn Δс
υ = –––––––––– = –––––––– = –––––––– (1)
(t2 – t1) • v Δt • v Δt
где c = n/v – концентрация вещества
