Лекция 5
1. Межмолекулярные взаимодействия. Комплексные соединения.
Силы Ван дер Ваальса. Водородная связь. Комплексные соединения. Строение комплексных соединений. Характер связи в комплексных соединениях с позиции метода валентных связей. Понятие о теории кристаллического поля и теории поля лигандов. Диссоциация комплексных соединений в растворе. Константа нестойкости.
Свойства веществ зависят не только от внутримолекулярного строения, но и от различных межмолекулярных взаимодействий.
Силы межмолекулярного взаимодействия называются силами Ван дер Ваальса (1900) – по имени датского ученого, впервые изучившего количественную характеристику этих сил.
Межмолекулярное взаимодействие имеет электрическую природу и отличается от химического тем, что оно проявляется на значительно больших расстояниях (0,4-0,7 НМ) и характеризуется небольшими энергиями связи (8–50 кДж/моль).
Молекула соединения в целом нейтральна, однако представляет собой совокупность положительных и отрицательно заряженных частиц.
Графическое изображение различных молекул:

При сближении молекул между ними возникает электростатическое взаимодействие трех видов:
1) ориентационное – полярная молекула (А) взаимодействует с полярной (В)
2) индукционное – полярная молекула (А) взаимодействует с неполярной молекулой (В) и индуцирует в ней небольшой дипольный момент
3) дисперсионное – неполярная молекула (А) взаимодействует с неполярной (В). Дисперсия (рассеяние) электрона создает синхронное появление и исчезновение мгновенных диполей молекул А и В, что и приводит к их притяжению:
Общая энергия взаимодействия определяется суммой энергией ориентационного индукционного и дисперсионного взаимодействий:
Еобщ = Ео + Еи + Ед.
Межмолекулярное взаимодействие осуществляется любыми молекулами различного агрегатного состояния. В газах оно минимально, в твердых веществах – максимально, в жидком состоянии занимает промежуточное положение между газообразным и твердым.
5.1. Водородная связь
Впервые образование водородной связи было обнаружено в 80-годах XIX века русскими учеными М. Ильинским и Н. Бекетовым.
Н-связь – это связь двух сильно электроотрицательных атомов посредством атома водорода. Общую схему образования такой связи можно представить так:
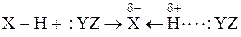 ,
,
X = Y = F, O, N, реже Cl, Br, C.
Атом водорода, связанный с сильно электроотрицательным атомом Х поляризован положительно. Поэтому он взаимодействует с другим сильно электроотрицательным атомом Y, обязательно имеющим неподеленную электронную пару. Энергия H-связи составляет 8-50 кДж/моль. Она может возникнуть между однородными и разнородными молекулами, а также внутри одной молекулы. Примеры:
1) H2O, 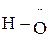
2) Раствор соляной кислоты
3) Спирты, карбоновые кислоты
4) Салициловая кислота
5) Белки
Природа Н-связи даже в настоящее время не вполне ясна. Она, в основном имеет электростатический характер. Главную роль в ее образовании играют следующие факторы:
1) поляризация связи атома Н превращает его в частицу (протон) с уникальными свойствами – отсутствие собственной электронной оболочки, наличие самого малого радиуса, способность протона внедряться в электронное поле других атомов.
2) донорно-акцепторное взаимодействие. Акцептор-протон одной молекулы, донор электроотрицательный атом другой молекулы.
Н-связи проявляется почти повсеместно: в молекулах белков, нуклеиновых кислот, а также в процессах смачивания (пищи слюной), набухания, адсорбции. С помощью Н-связи определяются специфичность действия лекарств, вкусовые качества, сокращения мышц, функции памяти.
Н-связь сильно влияет на физико-химические свойства газообразных водородных соединений и объясняет многие их аномальные свойства (например воды).
5.2. Комплексные соединения (КС)
КС – это соединения, образующие сложные ионы, способные существовать в растворе и кристалле. К ним относится обширный класс неорганических и металлоорганических соединений:
5.3. Строение КС
Строение и свойства КС объясняет координационная теория, предложенная швейцарским химиком А. Вернером (1893). Впоследствии теория была дополнена русским ученым Л. Чугаевым.
Рассмотрим строение 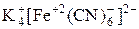 с позиции современной координационной теории.
с позиции современной координационной теории.
1. Центральное место в КС занимает комплексообразователь – обычно это катион металла. В нашем примере – Fe2+.
2. Вокруг комплексообразователя скоординированы лиганды (партнеры), т.е. анионы или нейтральные молекулы. Их количество определяет координационное число (КЧ). В нашем примере лигандами являются цианид-анионы СN–, КЧ = 6.
3. Комплексообразователь и лиганды образуют внутреннюю сферу комплекса – сложный комплексный ион. В нашем случае 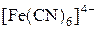 , он всегда записывается в квадратных скобках.
, он всегда записывается в квадратных скобках.
4. Ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу комплекса. У нас – четыре иона К+.
5. Сплошная линия в графическом изображении комплекса означает химическую связь, возникшую по обменному механизму (механизму спаривания), а пунктирная линия – связь, образованную по донорно-акцепторному механизму.
6. Причина образования комплекса – стремление атомов к насыщаемости (максимальной валентности).
5.4. Характер связи в КС с позиции МВС
Комплексообразующая способность определяется тремя факторами: радиусом, зарядом и электронной конфигурацией атома-комплексообразователя.
Из четырех семейств S-, p-, d- и f-элементов лучшими комплексообразователями являются d-элементы, так как они имеют малый радиус, большой заряд и удобную электронную конфигурацию, которая позволяет образовывать связи по обменному и донорно-акцепторному механизму.
С позиции МВС образование КС происходит за счет обменного и донорно-акцепторного механизма. Обменный механизм проявляется в связи комплексообразователя и внешней сферы или с частицами лигандов. Донорно-акцепторный механизм чаще всего осуществляется за счет неподеленных электронных пар лигандов и свободных орбиталей комплексообразователя. Например, в соединении 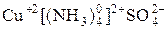 :
:
[Cu+2 −− − − − ] +2 SO4-2
5.5. Понятие о теории кристаллического поля и теории поля лигандов
В теории кристаллического поля предполагается, что между лигандами и комплексообразователям происходит сложное электростатическое взаимодействия. С одной стороны, имеются силы притяжения между положительно заряженными катионами и комплексообразователя и отрицательно заряженными лигандами или полярными молекулами лиганда. С другой стороны, отрицательно заряженные лиганды или дипольные молекулы лигандов отталкиваются друг от друга, а также от внешних электронов комплексообразователя. Лиганды располагаются вокруг комплексообразователя таким образом, чтобы силы притяжения были максимальны, а силы отталкивания – минимальны.
Таким образом, лиганды оказывают влияние на энергетическое состояние d-электронов комплексообразователя.
Изобразим энергию d-орбиталей в изолированном атоме и в полях лигандов.
В октаэдрическом поле лигандов энергия d-орбиталей, расположенных вдоль осей x, y, z, возрастает, а энергия d-орбиталей, направленных между осями x, y, z, уменьшается. Таким образом, происходит расщепление d-подуровня на величину Dокт.
В тетраэдрическом поле лигандов Dтетр меньше, чем Dокт и расположение d-орбиталей обратное октаэдрическому.
По влиянию на величину энергии ращепления D у 3d-элементов лиганды располагаются в ряд:
5.6. Диссоциация КС в растворе
Внутренняя и внешняя сферы комплекса различны по устойчивости. Ионы внешней сферы диссоциируют легко по типу солей. Эта диссоциация называется первичной. Лиганды внутренней сферы диссоциируют по стадиям и в очень малой степени. Эта диссоциация называется вторичной. Например,
Первичная диссоциация:
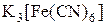 == 3K+ + [Fe(CN)6]3− , диссоциация велика.
== 3K+ + [Fe(CN)6]3− , диссоциация велика.
Вторичная диссоциация:
[Fe(CN)6] 3− == Fe3+ + 6CN− , диссоциация крайне мала.
Прочность КС определяется величиной константы нестойкости (КН), чем она больше, тем менее прочен комплекс.
Запишем диссоциацию КС в общем виде:
[KLn] == K + nL,
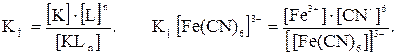
Д.з. Г., с. 154-156, 582-586, 594-604;
К., с. 65-81.
