Энергии Гиббса и Гельмгольца. Критерий самопроизвольного протекания процессов.
Свободная энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции;
Классическим определением энергии Гиббса является выражение
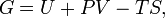
где 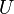 — внутренняя энергия,
— внутренняя энергия, 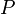 — давление,
— давление, 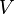 — объём,
— объём, 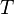 — абсолютная температура,
— абсолютная температура, 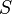 — энтропия.
— энтропия.
Свободная эне́ргия Гельмго́льца — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
На основании уравнения Больцмана можно показать, что любой необратимый процесс, самопроизвольно протекающий в изолированной системе, характеризуется увеличением энтропии.
Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
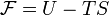 , где
, где 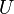 — внутренняя энергия,
— внутренняя энергия, 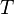 — абсолютная температура,
— абсолютная температура, 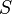 — энтропия.
— энтропия.
Скорость химических реакций, и ее зависимость от природы и концентраций реагентов. Закон действия масс (ЗДМ) для гомогенных и гетерогенных реакций.
Скорость реакции – это число элементарных актов взаимодействия,
происходящих в единицу времени в единицу объема для гомогенных реакций.
Чтобы произошла реакция, необходимо столкновение реагирующих частиц. Число столкновений растет с увеличением числа реагирующих частиц в единице объема, т.е. с увеличением концентрации веществ. Это утверждение нашло отражение в законе действующих масс.
Закон действия масс: скорость гомогенной реакции в каждый момент времени пропорциональна произведению концентрации реагирующих веществ, возведенных в некоторую степень.
В случае гетерогенных реакций в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе.
Действия масс закон — устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии.
Зависимость скорости реакции от температуры.
Зависимость скорости реакции от температуры
Правило Вант – Гоффа. Повышение температуры ускоряет большинство химических реакций. Согласно эмпирическому правилу Вант- Гоффа при повышении температуры на 10 К скорость многих реакций увеличивается в 2 – 4 раза
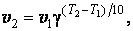
где v2 и v1 - скорости реакции при температурах Т2 и Т1, γ - коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2 – 4.
При концентрациях реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости k. Правило Вант – Гоффа запишется так:
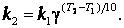
Уравнение показывает, что константа скорости зависит от температуры так же, как и скорость процесса.
Эти два уравнения можно использовать лишь для ориентировочных расчетов, так как точность их не очень высока.
