Условие самопроизвольного протекания red-ox процессов
В большинстве случаев химикам приходится отвечать на вопрос: возможно ли протекание окислительно-восстановительной реакции между данным реагентами, а если возможно, то какова полнота протекания такой реакции? Решению данной проблемы, часто вызывающей затруднения, посвящен этот параграф.
Известно, что не всякий окислитель в состоянии окислить данную восстановленную форму. Так, диоксид свинца PbO2 легко окисляет бромид-ион в кислой среде по реакции
PbO2 + 2Br– + 4H+ = Pb2+ + Br2 + 2H2O,
реакция окисления бромид-иона катионом железа(III)
2Fe3+ + 2Br– ≠ 2Fe2+ + Br2
не протекает.
Рассмотрев несколько подобных примеров, легко заключить, что различные окислители могут сильно отличаться друг от друга по своей окислительной (окисляющей) способности. Аналогичный вывод справедлив, разумеется, и по отношению к восстановителям.
Окислительная (восстановительная) способность данного окислителя (восстановителя) часто существенно зависит от условий проведения реакции, в частности, от кислотности среды. Так, бромат-ион легко окисляет бромид-ион
BrO3– + 5Br– + 6H+ = 3Br2 + 3H2O,
если кислотность достаточно высока, но окисление не происходит в слабокислотной и тем более в нейтральной или щелочной среде.
Источником наших знаний об окислительной способности различных окислителей, восстановительной способности восстановителей, влиянии кислотности среды на протекание ОВР и т.п. в конечном счете является опыт. Речь, конечно, идет не столько о нашем собственном опыте, который всегда ограничен, сколько о совокупном опыте многих поколений химиков, который к настоящему времени привел к созданию строгой и законченной количественной теории окислительно-восстановительных реакций, находящейся в полном соответствии с самыми точными экспериментами.
Термодинамическая теория ОВР использует результаты измерения электродных потенциалов и их строгого термодинамического расчета для однозначного ранжирования окислителей и восстановителей по их силе и формулирует точные уравнения, позволяющие заранее предсказать возможность и полноту протекания данной реакции в данных условиях.
При этом предполагается, что реакции на межфазных границах протекают достаточно быстро, а в объеме раствора – практически мгновенно. В неорганической химии, где реакции часто протекают с участием ионов, это предположение почти всегда оправдано (отдельные примеры термодинамически возможных реакций, которые на самом деле не протекают из-за кинетических затруднений, будут рассмотрены ниже).
При изучении ОВР в общей и неорганической химии одной из наших задач является обучение студентов осознанному применению простых качественных критериев самопроизвольного протекания ОВР в том или ином направлении в стандартных условиях и полноты их протекания в реально используемых в химической практике условиях (без учета возможных кинетических затруднений).
Прежде всего зададимся таким вопросом: от чего зависит окислительная способность окислителя, участвующего в той или иной полуреакции, например,
MnO4– + 8H+ + 5e = Mn2+ + 4H2O ?
Хотя при записи уравнений полуреакций и ионных уравнений ОВР в целом мы по традиции пользуемся знаком равенства, а не знаком обратимости, в действительности все реакции в той или иной степени химически обратимы, и поэтому в состоянии равновесия с равными скоростями всегда протекают и прямая и обратная реакции. Повышение концентрации окислителя MnO4– увеличивает, как известно из школьного курса химии, скорость прямой реакции, т.е. приводит к сдвигу равновесия вправо; при этом полнота окисления восстановителя повышается. К такому же выводу, естественно, приводит и использование принципа Ле-Шателье. Таким образом, окислительная способность окислителя всегда увеличивается с ростом его концентрации. Этот вывод представляется достаточно тривиальным и почти самоочевидным. Однако, рассуждая точно таким же способом, мы можем заключить, что окислительная способность перманганат-иона в кислотной среде увеличится при увеличении концентрации ионов водорода и уменьшится при увеличении концентрации катиона Mn 2+ (в частности, при его накоплении в растворе по мере протекания реакции). В общем случае окислительная способность окислителя зависит от коцентраций всех фигурирующих в уравнении полуреакции частиц. При этом ее повышению, т.е. процессу восстановления окислителя способствует увеличение концентрации частиц в левой части полуреакции; повышение же концентрации частиц в ее правой части, напротив, препятствует этому процессу.
Точно такие же выводы могут быть сделаны и в отношении полуреакций окисления восстановителя и окислительно-восстановительных реакций в целом (если они записаны в ионном виде).
Количественной мерой окислительной способности окислителя (и одновременно восстановительной способностиего восстановленной формы) является электрический потенциал электрода φ (электродный потенциал), на котором одновременно и с равными скоростями протекают полуреакция его восстановления и обратная ей полуреакция окисления соответствующей восстановленной формы. Этот окислительно-восстановительный потенциал измеряется по отношению к стандартному водородному электроду и характеризует пару «окисленная форма – восстановленная форма» (поэтому выражения «потенциал окислителя» и «потенциал восстановителя», строго говоря, неверны). Чем выше потенциал пары, тем сильнее выражена окислительная способность окислителя и, соответственно, слабее – восстановительная способность восстановителя. И напротив: чем ниже потенциал (вплоть до отрицательных значений), тем сильнее выражены восстановительные свойства восстановленной формы и слабее - окислительные свойства сопряженного с ней окислителя. Типы электродов, конструкция стандартного водородного электрода и методы измерения потенциалов детально рассматриваются в курсе физической химии.
Уравнение Нернста
Зависимость окислительно-восстановительного потенциала, отвечающего полуреакции восстановления перманганат-иона в кислой среде (и, как уже отмечалось, одновременно полуреакции окисления катиона Mn2+ до перманганат-иона в кислой среде) от перечисленных выше определяющих его факторов количественно описывается уравнением Нернста
φ(MnO4–, H+ / Mn2+) = φo(MnO4–, H+ / Mn2+) + RT / 5Fln[MnO4–][H+]8 / [Mn2+].
В общем случае уравнение Нернста принято записывать в так:
φ(Ox/Red) = φo(Ox/Red) + RT/(nF) ln [Ox]/[Red], 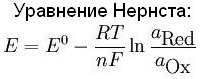
отвечающей записи полуреакции восстановления окислителя
Ox + ne- = Red
Каждая из концентраций под знаком натурального логарифма в уравнении Нернста возводится в степень, соответствующую стехиометрическому коэффициенту данной частицы в уравнении полуреакции, n – число принимаемых окислителем электронов, R – универсальная газовая постоянная, T – температура, F – число Фарадея.
Измерить окислительно-восстановительный потенциал в реакционном сосуде во время протекания реакции, т.е. в неравновесных условиях, невозможно, так как при измерении потенциала электроны должны передаваться от восстановителя к окислителю не непосредственно, а через соединяющий электроды металлический проводник. При этом скорость передачи электронов (силу тока)нужно поддерживать очень малой за счет приложения внешней (компенсирующей) разности потенциалов. Иначе говоря, измерение электродных потенциалов возможно только в равновесных условиях, когда прямой контакт между окислителем и восстановителем исключен.Поэтому квадратными скобками в уравнении Нернста обозначены, как обычно, равновесные (в условиях измерения) концентрации частиц. Хотя потенциалы окислительно-восстановительных пар во время протекания реакции нельзя измерить, их можно вычислить, подставляя в уравнение Нернста текущие, т.е. отвечающие данному моменту времени концентрации. Если рассматривается изменение потенциала по мере протекания реакции, то сначала это начальные концентрации, затем концентрации, зависящие от времени, и, наконец, после прекращения реакции, равновесные. По мере протекания реакции вычисляемый по уравнению Нернста потенциал окислителя уменьшается, а отвечающий второй полуреакции потенциал восстановителя, напротив, увеличивается. Когда эти потенциалы выравниваются, реакция прекращается, и система приходит в состояние химического равновесия.
