Свойства разбавленных растворов неэлектролитов. Понижение насыщенною пара растворителя над раствором. Осмос и осмотическое давление.
Свойства разбавленных растворов неэлектролитов
Понижение давления пара растворителя над раствором пропорционально мольной доле растворенного вещества. Суть явления с физической точки зрения - уменьшение поверхности испарения. С химической точки зрения - уменьшение количества молекул растворителя за счет сольватации.
Повышение Т кипения раствора - понижение давления пара растворителя приводит к необходимости увеличения температуры, при которой рпара=ратм (кипение).
Понижение температуры замерзания раствора (рПара над ж.=Рпара над тв.)*
Повышение Т кипения и понижение Т замерзания раствора не зависят от природы растворенного вещества, а зависят только от количества растворенных частиц (моляльной концентрации) -II закон Рауля.
□Ткип. = Em, Е - эбулиоскопическая константа 0Тзам. = Кт/ к " криоскопическая константа Е и К - характеристики растворителя.
Любая жидкость испаряется
Давление пара в состоянии равновесия называется давлением насыщенного пара. При данной температуре давление насыщенного пара над каждой жидкостью есть величина постоянная. Обозначим его как РА.
Примем, что любая жидкость может служить растворителем.
Любое растворённое вещество (твёрдое) теоретически тоже испаряется и, следовательно, имеет давление насыщенного пара. Обозначим его как РB.
Если твёрдое вещество нелетучее, то практически величина давления его насыщенного пара равна нулю.
Если раствор состоит из двух жидкостей, то растворителем считается та жидкость, у которой давление насыщенного пара выше.
Таким образом всегда РА > РB.
Давление насыщенного пара раствора (Р) представляет собой сумму парциальных давлений его компонентов:
1. P = РА NА + РB NB,
где NА и NB – мольные доли растворителя и растворённого вещества, соответственно.
Осмос
Осмос - переход растворителя через полупроницаемую перегородку в раствор - стремление к выравниванию концентраций. Имеет большое значение в биологии.
Давление, которое нужно приложить, чтобы прекратить осмос называется осмотическим давлением.
Осмотическое давление не зависит от природы компонентов раствора.
Вант-Гофф: осмотическое давление равно тому давлению, которое оказывало бы растворенное вещество на стенки сосуда, если бы оно находилось в о объеме раствора в газообразном состоянии.
РОСм.= гДе с " молярная концентрация.
Пользуясь этими законами можно определять молекулярные массы веществ, но надо помнить, что растворы должны быть разбавленными.
24 - Повышение температуры кипения и понижение температуры кристаллизации раствора. Антифризы
25 - свойства растворов слабых электролитов (а и Кл слабого электролита в растворе), уравнение Ван-Гоффа и Рауля для растворов слабых электролитов.
26 - Растворы сильных электролитов (a, i и Кд сильного электролита в растворе).
27 - Ионное произведение воды. Водородный и другие показатели среды.
Ио́нное произведе́ние воды́ — произведение концентрацийионовводорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
Является постоянной не только для чистой воды, но и для разбавленных водных растворов любых веществ. С повышением температуры увеличивается, с понижением — уменьшается. Однако для расчетов, относящихся к комнатной температуре, можно во всех случаях принимать ее равной 10-14
Позволяет для любого водного раствора найти концентрацию ионов водорода, если известна концентрация ионов гидроксида, и наоборот.
Для чистой воды концентрация ионов водорода равна корню квадратному из ионного произведения воды, то есть при комнатной температуре 10-7 моль/л. Такая среда считается нейтральной. Если концентрация ионов водорода выше 10-7 моль/л, то раствор считается кислым, а если ниже этого числа, то раствор щелочной.
Водоро́дный показа́тель, pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ «Пи эйч») — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионовводорода врастворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифмактивности водородных ионов, выраженной в молях на литр
28 – Гидролиз солей. Простой (обратимый) Гидролиз. Сложный (необратимый) Гидролиз
Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
29 – Степень и константа гидролиза. Значение Гидролиза.
30 - Электрохимия. Электродный потенциал. Гальванические Элементы металлические электроды. Уравнение Нернста.
31 – стандартный водородный электрод, его устройство и назначение. Расчет потенциала нестандартного водородного электрода.
Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную вводный раствор, содержащий ионы водорода. Потенциал пластины зависит от концентрации ионов Н+ в растворе.
Схема стандартного водородного электрода:
Платиновый электрод.
Подводимый газообразный водород.
Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
Водяной затвор, препятствующий попаданию кислорода воздуха.
Электролитический мост (состоящий из концентрированного р-раKCl), позволяющий присоединить вторую половину гальванического элемента.
Электродный потенциал нестандартного водородного электрода:
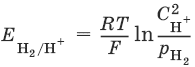
32 - Измерение величин стандартных потенциалов. Электроды сравнения. Ряд напряжений, его роль в оценке химических свойств металлов.
Электроды сравнения — электрохимические системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения величины потенциала отдельного электрода. Применяется, в частности, в составе электролитических ячеек.
Если расположить металлы в порядке возрастания их стандартных электродных потенциалов, то образуется так называемый электрохимический ряд напряжений металлов:
Li, Rb, К, Ва, Sr, Са, Nа, Мg, Аl, Мn, Zn, Сr, Fе, Сd, Со, Ni, Sn, Рb, Н, Sb, Вi, Сu, Hg, Аg, Рd, Рt, Аu.
Ряд напряжений характеризует химические свойства металлов.
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений металлов после него. Исключениями являются лишь щелочные и щелочноземельные металлы, которые не будут восстанавливать ионы других металлов из растворов их солей. Это связано с тем, что в этих случаях с большей скоростью протекают реакции взаимодействия металлов с водой.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т.е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Необходимо отметить, что представленный ряд характеризует поведение металлов и их солей только в водных растворах, поскольку потенциалы учитывают особенности взаимодействия того или иного иона с молекулами растворителя. Именно поэтому электрохимический ряд начинается литием, тогда как более активные в химическом отношении рубидий и калий находятся правее лития. Это связано с исключительно высокой энергией процесса гидратации ионов лития по сравнению с ионами других щелочных металлов.
33 - Определение ЭДС ГЭ Компенсационным методом.
Электродвижущей силой ё гальванического элемента называется разность потенциалов, возникающая на его полюсах при отсутствии разрядного тока.
Напряжение, непосредственно измеряемое на клеммах гальванического элемента вольтметром, меньше его э.д.с.. (U < Eэ).
Разница обусловлена омическим падением напряжения на внутреннем сопротивлении элемента и другими эффектами. Измерение э.д.с., обычно, проводят компенсационным методом, при котором ток, протекающий через элемент, близок к нулю. Для этого параллельно элементу подключают внешний источник тока, э.д.с. которого имеет противоположный знак. В измерительную цепь включают также гальванометр для измерения тока и вольтметр для измерения напряжения. В момент, когда выходное напряжение внешнего источника тока равно э.д.с. гальванического элемента (момент компенсации э.д.с.), ток в цепи и показания гальванометра равны нулю. Измеренное в этот момент вольтметром напряжение на клеммах гальванического элемента равно его э.д.с..
Достаточно близким к э.д.с. элемента будет напряжение, измеренное на его клеммах, высокоомным, например цифровым, вольтметром.
Э.д.с. гальванического элемента измеряют для экспериментального определения термодинамических функций токообразующих реакций.
34 - Концентрационный гальванический элемент, его устройство, химизм работы и расчет его ЭДС
Концентрационный элемент — это гальванический элемент, состоящий из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными концентрациями С1 > С2. Катодом в этом гальваническом элементе является электрод погруженный в раствор с большей концентрацией, а анодом соответственно погруженным в раствор с меньшей концентрацией.
35 - Практическое применение химических источников тока: сухие гальванические элементы, электрохимические аккумуляторы, топливные элементы.
36 - электролиз. его определение. Электролизер, его устройство. Электроды. Электролиз расплавов электролитов.
37 – Электролиз растворов электролитов. Катодные и анодные процессы.
Электролиз растворов электролитов
Главное отличие этого типа электролиза от электролиза расплавов состоит в том, что в водных растворах электролитов (при электролизе в качестве электролитов значительно чаще используют соли, чем кислоты или основания) кроме катионов и анионов электролита (соли) всегда присутствуют молекулы воды, а также ионы Н+ и ОН–, образующиеся в результате ее диссоциации, а в случае гидролиза соли — то и в результате гидролиза. Поэтому наряду с ионами растворенной соли в электродных реакциях могут принимать участие молекулы воды, ионы Н+ или ОН–.
Продукты, выделяющиеся на электродах, зависят от природы ионов соли, находящегося в растворе, а также вида материала, из которого изготовлены электроды.
Напомним, что в гальваническом элементе катодом называется положительный электрод, а анодом — отрицательный. При электролизе — наоборот. Но главное состоит в том, что и в гальваническом элементе и при электролизе на катоде идет восстановление, а на аноде — окисление.
38 - Законы Фарадея. Выход по току. Кинетика электродных процессов. Поляризация.
ЗАКОНЫ ФАРАДЕЯ, два закона ЭЛЕКТРОЛИЗА и три закона ЭЛЕКТРОМАГНИТНОЙ ИНДУКЦИИ, сформулированные Майклом ФАРАДЕЕМ. В современной интерпретации законы электролиза гласят, что (1) количество продуктов химических реакций в процессе электролиза пропорционально силе заряда и (2) количество продуктов химических реакций, которым подвергается вещество в результате воздействия некоторого количества электрического тока, пропорционально электрохимическому эквиваленту вещества. Законы электромагнитной индукции, сформулированные Фарадеем, гласят, что (1) электромагнитная сила индуцируется в проводнике при изменении окружающего проводник магнитного поля, (2) электромагнитная сила пропорциональна скорости изменения поля и (3) направление индуцируемой электромагнитной силы противоположно направлению изменения внешнего поля.
Выход по току – это выраженное в процентах отношение количества
фактически затраченного электричества (Qфакт) к теоретически необходимому(Qтеор):
Bт = (Qфакт/ Qтеор)·100%
Кинетика электродных процессов.
Общие понятия кинетики электродных процессов, электродная поляризация. Скорость электродных процессов, способы ее выражения. Основы теории электрохимического перенапряжения. Зависимость энергии активации электрохимической реакции от электродного потенциала. Кинетическое уравнение для катодного процесса. Кинетические параметры электрохимического перенапряжения (плотность тока обмена, коэффициент переноса). Уравнение Тафеля. Безбарьерный и безактивационный электродные реакции. Методы исследования природы поляризации. Основы теории совмещенных реакций. Построение результативной поляризационной кривой и разложение ее на составляющие.
ПОЛЯРИЗАЦИЯ в электрохимии, отклонение значения электродного потенциала от равновесного при пропускании электрич. тока. Величина поляризации зависит от плотности тока i, т.е. силы тока, отнесенной к единице пов-сти электрода, и обычно тем больше, чем больше i. При одном и том же значении i поляризация зависит от природы электрода и типа протекающей на его пов-сти р-ции, состава р-ра, т-ры и др. факторов и может колебаться от долей мВ до неск. В. Знак поляризации зависит от направления протекания тока и при изменении направления меняется на обратный.
39 - Электролиз раствора соли с инертным анодом; с активным анодом.
40 - Применение электролиза. Гальваностегия и гальванопластика, получение и рафинирование металлов.
41 - Коррозия металлов и сплавов. Классификация коррозионных сред, разрушений. Химическая коррозия.
42 - Электрохимическая коррозия (коррозия в электролитах, атмосферная коррозия, коррозия под действием блуждающих токов).
43 - Термодинамика и кинетика газовой и электрохимической коррозии.
44 - Основные факторы рационального конструирования. Легирование металлических материалов. Изменение состава и свойств коррозионной среды.
45 - Электрохимическая зашита металлов от коррозии: виды и механизм действия
46 - Защитные покрытия: виды, методы нанесения и области применения.
47 - Общие свойства металлов. Классификация металлов. Способы получения.
48 - Сплавы металлов. Их получение, классификация и применение.
