Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
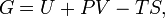
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Свобо́днаяэне́ргияГельмго́льца (или просто свобо́днаяэне́ргия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
Направленности нет! Найти.
Тоже
Химическое равновесие. Принцип Ле-Шателье.
Принцип Ле-Шателье
· Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
· Увеличение давления смещает равновесие в сторону реакции, ведущей к уменьшению объема.
· Повышение температуры смещает равновесие в сторону эндотермической реакции.
· Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещают равновесие в сторону прямой реакции.
· Катализаторы не влияют на положение равновесия.
Химическая кинетика. Основные понятия химической кинетики. Закон действующих масс. Молекурярность и порядок реакции
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение помножается на −1.
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Порядок химической реакции
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка
График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции
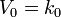 Кинетическое уравнение имеет следующий вид:
Кинетическое уравнение имеет следующий вид:
Реакция первого порядка
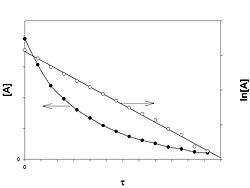

График зависимости концентрации реагента A для первого порядка реакции
Кинетическое уравнение реакции первого порядка:
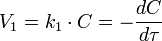
Приведение уравнения к линейному виду даёт уравнение:
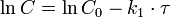
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
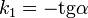
Период полупревращения:
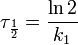
Реакция второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
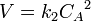
или
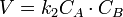
В первом случае скорость реакции определяется уравнением
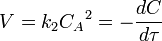
Линейная форма уравнения:
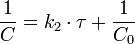
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
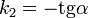
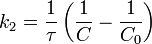
Во втором случае выражение для константы скорости реакции будет выглядеть так:
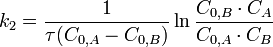
Молекулярность Реакции:
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
