Для борьбы с микроклещами морских свинок и мышей
Скорнякова О.О.
ФГБОУ ВО Вятская ГСХА, г. Киров, Россия
Лабораторные животные – прежде всего грызуны разных видов и кролики - используются для постановки биологической пробы, определения патогенности возбудителя, изучения действия лекарственных препаратов in vivo, а также в качестве доноров эритроцитов, физиологических и биологических моделей. Здоровье лабораторных животных является необходимым условием при использовании их в качестве модельных животных [1].
Существенную часть паразитарных болезней среди грызунов в вивариях занимают эктопаразитозы, возбудителями которых являются клещи подотряда Acariformes.
Myocoptes musculinus (семейство Myocoptidae) и Myobia muris-musculi (семейство Myobiidae) - мелкие клещи накожники размером 0,2-0,6 мм. Гнатосома расположена терминально, идиосома сильно уплощенная и слегка продолговатая, слабо склеротизована. Ноги крепятся к идиосоме латерально, щетинки волосовидные. Клещи M. murismusculi держатся на волосе и высасывают содержимое волосяного фолликула, лимфу и плазму крови. M. musculinus питаются ороговевшими эпидермальными чешуйками [2]. Эти эктопаразиты являются причиной зуда, беспокойства грызунов, большое их количество на теле животных может приводить к гибели молодняка [3].
Chirodiscoides caviae (семейство Chirodiscidae) - меховой (шерстный) клещ размером до 0,5 мм. Гнатосома расположена терминально, идиосома уплощенная, хорошо склеротизована. Ноги крепятся к идиосоме латерально, щетинки волосовидные. При заражении этим клещом характерно покраснение и шелушение кожи, выпадение шерсти и зуд [2].
До настоящего времени наиболее эффективным методом борьбы с эктопаразитами было купание их в растворе хлорофоса (1:100), что отрицательно сказывалось на здоровье людей, а кумулятивное действие фосов в организме лабораторных грызунов могло приводить к недостоверным данным валидности моделей [1].
Цель работы - изучение акарицидного действия Чистотел зооспрея и аверсектиновой мази на эктопаразитов морских свинок (Ch. caviae) и лабораторных мышей (M. musculinus, M. muris-musculi).
Материалы и методы исследований
Опыт ставили на грызунах, принадлежащих виварию ФГБОУ ВО Вятская ГСХА (г. Киров). Все животные в течение опыта содержались в деревянных клетках по 5-15 голов в каждой.
Грызунов осматривали и выщипывали пучки волос в области головы и вдоль позвоночника. Микроскопическому исследованию подвергали общую пробу, взятую из одной клетки. При взятии соскобов учитывали клинические признаки арахноэнтомозов (беспокойство, зуд, расчесы, наличие корочек, аллопеции, истощение). Микроскопию проводили с помощью бинокулярного микроскопа Микромед 1 (ув. 10х40, 10х10), фотографию паразитов - видеоокуляром серии Toup Cam 3.1 MP с использованием программного обеспечения анализа изображений.
В общей сложности было обследовано 203 белых мыши и 43 головы морских свинок породы розетчатые, гладкошерстные двух- и трехцветные и разного пола и возраста.
Для оценки степени пораженности эктопаразитами подсчитывали показатель экстенсивность инвазии - процент зараженных проб от числа исследованных.
Для сравнительной оценки двух препаратов были сформированы 2 опытные группы. Для лечения животных первой опытной группы использовали Чистотел (перметрин) в форме спрея. Чистотел зооспрей применяли накожно в области затылка в дозе 1 пшик (0,2 мл) на животное, двукратно с интервалом 10 дней. Всего обработано 78 мышей и 23 морских свинки.
Для лечения животных второй опытной группы применяли аверсектиновую мазь 0,05%-ной концентрации (аверсектин С). Мазь наносили зубной щеткой накожно вдоль позвоночного столба против шерсти в дозе 0,2-0,3 мг на 1 см2, двукратно с интервалом 10 дней. Всего обработано 125 мышей и 20 морских свинок.
Оценку качества проведенного лечения (наличие паразитов, учитывая их биологические особенности (в частности, постоянное нахождение на теле животных для питания)) определяли при поголовном осмотре морских свинок и мышей и подтверждали микроскопией соскобов через 14 и 30 дней после обработки. В течение опыта за животными вели наблюдения.
В результате проведенных микроскопических исследований установлена различная зараженность грызунов эктопаразитами.
Морские свинки заражены Ch. caviaе. Экстенсивность заражения шерстным клещом составила 61,5%. При микроскопическом исследовании были обнаружены многочисленные яйца и имаго Ch. caviae (рис. 1а) преимущественно в больших семьях, как на взрослых животных, так и на поросятах. У зараженных животных отмечали расчесы, аллопеции.
При микроскопии соскобов белых мышей обнаружены яйца и имаго клещей накожников M. muris-musculi и M. musculinus (рис. 1б, в) во всех исследуемых пробах. Экстенсивность инвазии клещами накожниками составила 100%. У зараженных мышей отмечали аллопеции, истощение, отсутствие приплода.

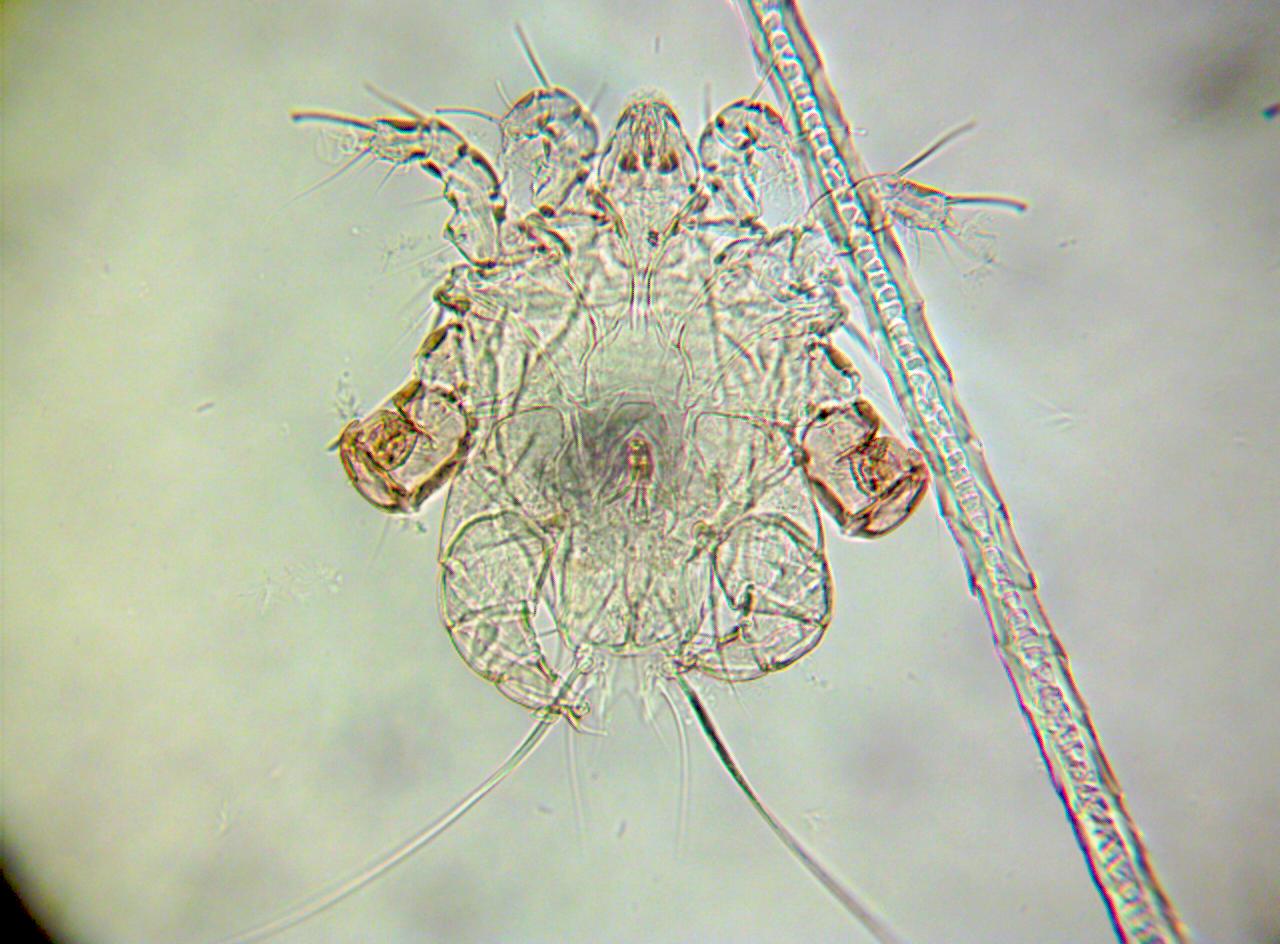

а б в
Рисунок 1 – Микроклещи морских свинок и мышей: а - Chirodiscoides caviae дорсально (х100); б - Myobia muris-musculi вентрально; в - Myocoptes musculinus дорсально (х400)
После двукратной обработки морских свинок и мышей аверсектиновой мазью установили выраженное акарицидное действие на Ch. caviae, M. muris-musculi и M. musculinus. В период наблюдения (30 дней) не отмечено зуда и покраснения участков тела животных, обработанных аверсектиновой мазью.
Обработка морских свинок Чистотел зооспреем показала выраженный акарицидный эффект на Ch. caviae. Клещи накожники, наоборот, оказались резистентны к перметрину.
По результатам наших исследований можно сделать следующий вывод, что наибольшей акарицидной активностью против эктопаразитов лабораторных животных обладает аверсектиновая мазь 0,05%-ной концентрации, содержащая в качестве действующего вещества аверсектин С, что позволяет рекомендовать ее для лечения эктопаразитозов лабораторных и декоративных животных.
Литература
1. Аронов, В.М. Опыт применения электрохимически активированного раствора для борьбы с микроклещами морских свинок // Теория и практика борьбы с паразитарными болезнями. - 2012. - Вып. 13. - С. 25-28.
2. Бочков, А.В. Морфологические адаптации акариформных клещей (Acari: Acariformes) к постоянному паразитизму на млекопитающих // Паразитология. - М., 2007. - Т.41. - Вып. 6. - С. 428-458.
3. Шемякова, С.А., Шемяков, Д.Н. Паразитарные болезни лабораторных грызунов // Материалы XVI ветеринарного конгресса. - М., 2008. - С. 74-76.
УДК 637.4.04
