Анализ плоскостной хроматограммы
Разделяемые компоненты образуют на хроматографической пластинке или полоске хроматографической бумаги отдельные зоны (пятна). 
Положение отдельных хроматографических зон на хроматограмме характеризуют с помощью величины Rf, равной отношению расстояния, пройденного зоной вещества от стартовой линии до центра зоны (x), к расстоянию от стартовой линии до границы фронта растворителя к концу опыта (L):Rf= Х/L
Подвижность разделяемых веществ можно также сравнить с подвижностью вещества, принятого за стандарт: 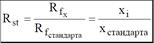

Рассчитывают коэффициент разделения (α) и разрешение (RS) (см вопр 61)
Плоскостная хроматография используется, главным образом,для обнаружения и идентификации веществ.
95. Понятие о гибридных методах анализа. Масс-спектроскопия. Хромато-масс-спектроскопия.
Масс-спектрометрия — метод исследования вещ-ва путём определения отношения массы к заряду и кол-ва заряженных частиц, обр.при том или ином процессе воздействия на вещество.
Масс-спектрометры-приборы для разделения ионизированных частиц вещества (молекул, атомов) по их массам, основанные на воздействии магнитных и электр.полей на пучки ионов, летящих в вакууме. В масс-спектрометрах регистрация ионов осуществляется электр. методами, в масс-спектрографах — по потемнению чувствительного слоя фотопластинки, помещаемой в прибор.
Масс-спектрометры имеют широкий динамический диапазон: от 5-6 порядков для анализа вещества орг.природы до 9-10 порядков для элементного анализа вещ-в.
Масс-спектрометр обычно сод. устройство для подготовки исследуемого вещ-ва ; ионный источник, где это вещество частично ионизуется и происходит формирование ионного пучка; масс-анализатор , в котором происходит разделение ионов по массам, приёмник ионов , где ионный ток преобразуется в электрический сигнал, который затем усиливается и регистрируется. В регистрирующее устройство, помимо информации о количестве, из анализатора поступает также информация о массе ионов. Масс-спектрометр содержит также системы электрического питания и устройства, создающие и поддерживающие высокий вакуум в ионном источнике и анализаторе.
Масс-спектр - это зависимость интенсивности ионного тока от отношения массы к заряду. Каждый из пиков ионного тока соответствует однозарядным ионам изотопов. Отношение массы иона к ширине m пика (в единицах массы) 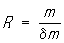 - разрешающая способность масс-спектрометра.
- разрешающая способность масс-спектрометра.
Различают статические (используются электрические и магнитные поля )и динамические(для разделения ионов с разными m/е используют разные времена пролёта ионами опр.расстояния) масс-спектрометры.
Хромато-масс-спектрометрия. Метод анализа смесей и определения следовых количеств веществ в объеме жидкости. Метод основан на комбинации двух самостоятельных методов – хроматографии и масс-спектрометрии. С помощью первого осуществляют разделение смеси на компоненты, с помощью второго -идентификацию и определение строения вещества, количественный анализ.
Хромато-масс-спектометр включает три основные части: хроматограф (обычно газовый или жидкостный), масс-спектометр и интерфейс – специфический узел, обеспечивающий соединение и совместную работу хроматографических и масс-спектрометрических приборов.
Газовый поток из хроматографической колонки через первую форсунку со сверхзвуковой скоростью попадает в область вакуума, где молекулы распростр. со скоростями, обратно пропорциональными их массе. В результате более легкие и быстрые молекулы газа-носителя откачиваются насосом, а более медленные мол. орг. вещ-ва попадают в отверстие второй форсунки, а затем в ионный источник масс-спектрометра. Некоторые приборы снабжены двухстадийным мол. сепаратором, снабженным еще одним подобным блоком форсунок. В объеме между ними созд. высокий вакуум. Чем легче мол. газа-носителя, тем эффективнее они удал.из газ. потока и тем выше обогащение орг. вещ-вом. Наиб. удобный газ-носитель - гелий.
96. Общая характеристика электрохимических методов.
1. Методы, связанные с электродными реакциями:
а)с применением пост. факторов возбуждения (потенциометрия, кулонометрия, электрогравиметрия)
б)с применением переменных факторов возбуждения(вольтамперометрия)
2.Методы,в кот. не должны приниматься во внимание ни двойной электр. слой,ни какие-либо эектрон. реакции
3 . Методы, связанные с явлениями в двойном электр. слое, но для кот. не должны приниматься во внимание никакие электродные р-ции
4.прямые(используется зависимость электрического параметра от концентрации вещества)
5.косвенные(изменение величины электрического параметра используется для обнаружения конечной точки титрования)
97. Электрохимические методы анализа. Характеристика электродов и принцип работы электрохимической ячейки. Поляризация электродов.
Электродом называется граница раздела, на которой электронный механизм переноса заряда (направленное движение электронов) меняется на ионный (направленное движение ионов). В менее строгом смысле под термином «электрод» обычно подразумевают проводник электрического тока с электронной проводимостью. Электролитом называется среда, в которой происходит перенос заряда в результате направленного движения ионов. Электроды, входящие в состав электрохимической ячейки, могут находиться в одном растворе либо в разных растворах, контактирующих друг с другом с помощью солевого мостика или через пористую перегородку. Ячейки первого типа называются ячейками без жидкостного соединения, второго типа - ячейками с жидкостным соединением.
Электрохимической ячейкой наз. система, сост. из пары электродов и электролита, контактирующих между собой. Электродом наз. граница раздела, на кот. электронный мех-м переноса заряда меняется на ионный . Электролитом наз. среда, в кот. происходит перенос заряда в результате направленного движ. ионов.
Ячейки первого типа называются ячейками без жидкостного соединения, второго типа - ячейками с жидкостным соединением.
В сост. электрохим. ячейки должно входить, по крайней мере, два электрода: индикаторный электрод и электрод сравнения. На практике в качестве электродов сравнения чаще всего применяют хлоридсеребряный и каломельный электроды.
В состав электрохимической ячейки может входить ещё и третий электрод - вспомогательный. Этот электрод служит источником электронов или играет роль стока электронов ,обеспечивая возможность протекания электр. тока через ячейку.
Если во внешней цепи начинает протекать электр. ток, то это приводит к отклонению величины потенциала электрода .Такое явление называется поляризацией, а электрод - поляризованным.
Концентрационная поляризация возникает вследствие медл. диффузии вещества из объёма р-ра к поверхности электрода и приводит к уменьш. потенциала электрода. Для уменьш. концентрационной поляризации, анализируемый раствор пост. перемешивают.
Кинетическая поляризация, или перенапряжение обусловлена медленным переносом электронов на поверхности электродов. Величина кинетической поляризации зависит от природы окислительно-восст. сис-мы и материала электрода.
98. Кондуктометрический метод анализа. Теоретические основы. Измерение аналитического сигнала. Кондуктометрическое титрование. Понятие о высокочастотной кондуктометрии.
Кондуктометрия - это сов-ть электрохим. методов анализа, основанных на измер. удельной электропроводности растворов электролитов.
Любое вещ-во характер. своим электр. сопротивлением (R-{Ом}). Величина обратная сопротивлению называется электропроводностью или электрической проводимостью (G-{См}). Для раствора электролита, находящегося между двумя электродами, площадь поверхности которых равна S и расстояние между которыми равно l:

Удельная электропроводность 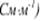 численно равна силе тока, проходящего через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1В на единицу длины.
численно равна силе тока, проходящего через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1В на единицу длины.
Удельная электропроводность связана с молярной концентрацией эквивалента вещества (моль/л): K = 1/ρ
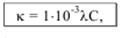 эквивалентная электропроводность –
эквивалентная электропроводность – 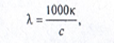
Измерение аналитического сигнала. Контактные кондуктометрические измерения проводят в ячейке для измерения электропроводности. Простейшая ячейка предст. собой стеклян.сосуд с двумя плоскопараллел. платиновыми электродами. Раствор,находящийся в ячейке, постоянно перемешивается. Ячейку подключают к источнику переменного тока с частотой около 1000 Гц. Непосредственно измеряемой величиной в кондуктометрии является не электропроводность, а сопротивление.Сопротивление р-ра можно измерять с пом. моста Уитстона. Мосты переменного тока могут быть уравновешенными и неуравновешенными. В случае уравновешенного моста величины сопротивлений R1, R2 и R3 должны быть такими, чтобы мост пришёл в состояние равновесия, при котором сила тока в измерительной диагонали равна нулю (или имеет минимальное значение). Измерить с удовлетвори тельной точностью величины и S трудно, поэтому вначале измеряют сопротивление раствора, удельная электропроводность которого точно известна. В качестве такого стандарта используется раствор KCl.
Кондуктометрическое титрование основано на изменении удельной электропроводности раствора в зависимости от количества добавленного титранта. Точку эквивалентности опр. по изменению электропроводности раствора. Электропроводность измеряют после добавл.каждой порции титранта. Зависимость электропров. от кол-ва добавлен. титранта наз. кривой кондуктометрического титрования. Они имеют излом, соответствующий точке эквивалентности.
Преимущество метода- возможность определения вещ-в в многокомпонентных смесях в водных растворах.
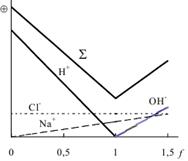 Кривая титрования HCl раствором NaOH
Кривая титрования HCl раствором NaOH
Понятие о высокочастотной кондуктометрии. Используется электр. ток высокой частоты. Электроды в ячейках для высокочаст. титрования не соприкасаются с анализир. р.р-ром. Сущ. два типа таких ячеек: емкостная(измеряют измен. частоты генератора в процессе титрования) и индуктивная(помещ. внутрь электромагн.катушки ).
99. Кулонометрический метод анализа. Общая характеристика. Прямая кулонометрия. Практическое применение.
Кулонометрическими называют электрохимические методы анализа, основанные на измерении количества электричества, прошедшего через электролитическую ячейку (при электрохимическом окислении или восстановлении вещества на рабочем электроде). Кулонометрия – это безэталонный метод анализа.
Массу определяемого вещества при кулонометрических определениях рассчитывают непосредственно из количества пропущенного электричества (в кулонах). В основе кулонометрии лежат законы Фарадея для электролиза. Объединенный закон Фарадея: Количество вещества, выделенного на электродах, прямо пропорционально количеству прошедшего электричества и молярной массе эквивалента вещества: m = (M/nF)•Q, где m – масса вещества, окисленного (восстановленного) в процессе электролиза; M – молярная масса вещества; n – число электронов, участвующих в электродной реакции; F – постоянная Фарадея (F = 96487 Кл/моль 9,65104 Кл/моль), Q – количество электричества,Кл.
Условия проведения кулонометрического анализа:
- Необходимо, чтобы отсутствовали побочные химические и электрохимические процессы, т.е. выход по току должен быть равен 100%
- определяемый элемент окислителя (восстанавливался) только до одной точно известной степени окисления
- был известен способ определения количества электричества или момента завершения реакции.
Прямая кулонометрия - используется для определения соединений Cu, Au, Ag, Tl, Sb и других элементов, а также для хинонов и гидрохинонов, многоатомных фенолов, нитро-, нитрозо- и азосоединений, галогенопроизводных и т.д. Прямые кулонометрические определения обычно проводят при постоянном потенциале.
Прямая кулонометрия при постоянной силе тока используется в тех случаях, когда определяемое вещество находится на поверхности электрода или предварительно выделено на этой поверхности. 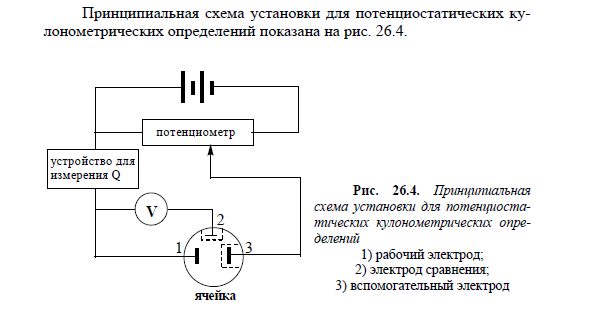 Если на рабочем электроде протекает электрохимическая реакция первого порядка, то сила тока с течением времени уменьшается по экспоненциальному закону. Практически при проведении электролиза всегда остается некоторый фоновый ток (Iф), обусловленный превращением примесей, поэтому обычно электролиз считают законченным, когда сила тока станет равной 0,01-0,001 от первоначального значения. Для определения количества электричества, прошедшего через электролитическую ячейку, используют следующие приёмы: с помощью электронного интегратора тока, с помощью химического интегратора тока("кулонометра"), как площадь под кривой "ток-время".
Если на рабочем электроде протекает электрохимическая реакция первого порядка, то сила тока с течением времени уменьшается по экспоненциальному закону. Практически при проведении электролиза всегда остается некоторый фоновый ток (Iф), обусловленный превращением примесей, поэтому обычно электролиз считают законченным, когда сила тока станет равной 0,01-0,001 от первоначального значения. Для определения количества электричества, прошедшего через электролитическую ячейку, используют следующие приёмы: с помощью электронного интегратора тока, с помощью химического интегратора тока("кулонометра"), как площадь под кривой "ток-время".
100. Кулонометрический метод анализа. Кулонометрической титрование. Практическое применение.
В кулонометрическом титровании аналитическим сигналом является не объём стандартного раствора титранта, а количество электричества, которое необходимо для его получения. Кулонометрическое титрование, в отличие от прямой кулонометрии, используется для определения электронеактивных веществ. Измерения в кулонометрическом титровании проводятся при постоянной силе тока. Количество электричества при таком режиме измерения равно произведению силы тока на время электролиза. В основе кулонометрического титрования могут лежать различные типы химических реакций. Конечную точку кулонометрического титрования обнаруживают визуально с помощью индикатора или инструментальными методами (потенциометрически, амперометрически, фотометрически и др.). Перед проведением титрования обычно проводят предварительное титрование для удаление возможных примесей посторонних веществ и устранение погрешности, связанной с состоянием поверхности рабочего электрода. Преимущества кулонометрического титрования перед другими титриметрическими методами анализа заключаются в том что:
- титрант не нужно готовить, стандартизировать и хранить;
- можно получать титранты (например, Fe2+ или Cl2), которые сложно или невозможно приготовить обычным способом;
- титрант легче «дозируется» (отрегулировать силу тока значительно легче, чем добавить точный объём титранта);
- раствор в процессе титрования не разбавляется;
- в процессе предэлектролиза можно устранить мешающее влияние примесей;
- одну и ту же ячейку можно использовать для любого вида титрования;
- процесс анализа можно легко автоматизировать.
101. Потенциометрический метод анализа. Принцип работы и основные характеристики ион-селективных электродов.
Потенциометрическими называют методы анализа, основанные на измерении зависимости равновесного электродного потенциала от активности определяемого иона. При потенциометрических измерениях используется электрохимическая ячейка, работающая в режиме гальванического элемента. В состав ячейки входит индикаторный электрод, потенциал которого зависит от активности определяемого иона или от активности хотя бы одного из компонентов протекающей химической реакции, и электрод сравнения (чаще всего хлоридсеребряный), величина потенциала которого постоянна. Величина потенциала индикаторного электрода связана с активностью определяемого иона уравнением Нернста(стр 327). Потенциометрия бывает прямая («ионометрия» - измеряют величину ЭДС и по ней находят концентрацию определяемого иона) и косвенная («потенциометрической титрование» - измеряют величину ЭДС, которая изменяется в ходе химической реакции между веществом и титрантом). Условия измерения аналитического сигнала:
- сила тока, протекающего через ячейку, должна быть равна 0;
- время, в течение которого проводится измерение, должно быть достаточным для достижения равновесия.
При измерении ЭДС в таких условиях можно считать, что величина соотношения аокисл/ aвосст у поверхности электрода равна величине этого соотношения в растворе.
Методы измерения ЭДС: компенсационный (Используют потенциометр Погендорфа) и некомпенсационный (Используют электронный вольтметр с очень большим входным сопротивлением). Приборы, позволяющие определять величину рХ (отрицательного логарифма активности иона Х в растворе), в комплекте с соответствующими ионо-селективными электродами, называются иономерами. Если прибор предназначен для измерения активности только катионов водорода, то его называют рН-метром.
Индикаторные электроды – металлические (имеют электронную проводимость) и неметаллические (имеют ионную проводимость). Ионоселективные электроды – это чувствительные элементы, потенциалы которых линейно зависят от lg активности определяемого иона в растворе. В состав ионоселективных электродов входит полупроницаемая мембрана, представляющая собой тонкую плёнку, отделяющую внутренний раствор (стандартный) от внешнего (анализируемого) и способную пропускать преимущественно ионы только одного вида.
Основные характеристики: интервал выполнения электродной функции, время отклика (Время, за которое потенциал электрода достигает постоянного значения. Чем меньше время отклика, тем лучше электрод) и селективность (Определяется потенциометрическим коэффициентом селективности, отражающим относительное влияние ионов А и В на величину мембранного потенциала. Чем меньше его величина, тем выше селективность электрода относительно иона А).
Виды ион-селективных электродов:
- с кристаллическими мембранами
- с жесткой матрицей (стеклянные, имеют стеклянную мембрану обладающую селективностью по отношению к определённому иону)
- с подвижными носителями (имеют жидкую мембрану - раствор ионообменника или "нейтрального переносчика" в
органическом растворителе, удерживаемый на пористом полимереили заключённыйв полимернуюматрицу)
- газочувствительные (датчики, состоящие из индикаторного электрода и электрода сравнения и имеющие газопроницаемую мембрану или воздушный зазор для отделения анализируемого раствора от тонкой плёнки промежуточного раствора электролита)
- ферментные (датчики, в которых ИСЭ покрыт плёнкой, содержащей фермент, способный вызвать реакцию превращения субстрата с образованием веществ, на которые реагирует электрод)
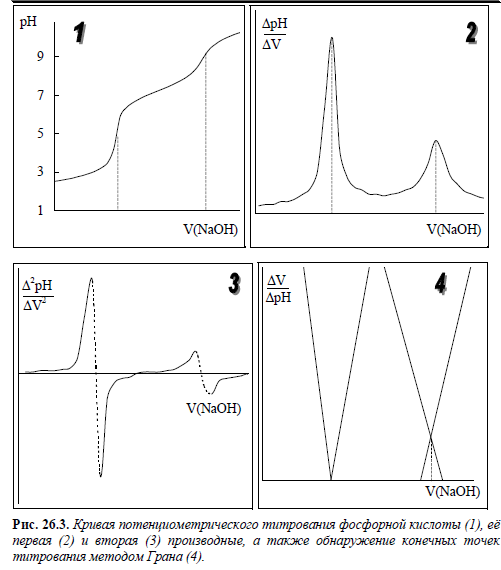
102.Потенциометрический метод анализа. Обнаружение конечной точки титрования с использованием кривой титрования, её производных и метод Грана.
Конечную точку титрования обнаруживают с использованием кривой титрования, её производных, а также методом Грана. На рис. 26.3 показаны различные варианты обнаружения конечной точки титрования фосфорной кислоты гидроксидом натрия. Конечной точке титрования на исходной кривой титрования соответствует точка максимального наклона (точка перегиба) кривой, на её первой производной – точка максимума, второй производной – точка пересечения прямой, соединяющей две ветви кривой, с осью абсцисс. При использовании метода Грана конечной точке титрования соответствует точка пересечения прямых.