Свойства разбавленных растворов электролитов и неэлектролитов
Изучение темы «Осмотические свойства растворов» и криометрического метода анализа необходимо для объяснения механизма процессов гемолиза и плазмолиза, явления изоосмии, знание которых, в свою очередь, позволяет поддерживать жизнедеятельность организма и проводить экспериментальные исследования на выделенных из организма органах и тканях.
Основные законы и понятия названной темы используются при изучении медико-биологических дисциплин и в практической деятельности врача при приготовлении гипотонических, гипертонических и изотонических растворов лекарственных веществ.
Криометрический метод широко используется для определения молекулярной массы различных биологических жидкостей. Впервые молекулярная масса крови была определена этим методом. Криометрическим методом можно определить различные характеристики осмотических свойств растворов: осмотическую концентрацию, осмотическое давление и другие. Особенно важно то, что криометрический метод позволяет анализировать лекарственные препараты на суммарное содержание примесей и тем самым идентифицировать их как фармацевтически пригодные.
Конечная цель работы:
§ Изучить свойства разбавленных растворов криометрическим методом.
§ Научиться определять криометрическим методом молярную массу растворенного вещества, осмотическое давление и осмотическую концентрацию раствора, а также изотоничность исследуемых растворов.
Учебно-целевые задачи:
§ Экспериментально с помощью термометра Бекмана определить понижение температуры замерзания раствора.
§ Используя экспериментальные данные рассчитать:
§ Молярную массу растворенного неэлектролита
§ Осмотическую концентрацию раствора электролита
§ осмотическое давление исследуемого раствора.
Физико-химические свойства растворов отличаются от чистых растворителей. В свою очередь, свойства разбавленных растворов, такие как осмотическое давление пара над растворителем, температура кипения, температура кристаллизации значительно отличаются от тех же свойств растворов более высокой концентрации.
В разбавленных растворах относительная доля сольватированного растворителя невелика, образовании таких растворов сопровождается небольшими тепловыми эффектами, поэтому свойства их можно считать малозависящими от природы растворяемого вещества. Концентрированные растворы имеют свои закономерности, точно также как разный поход должен быть при изучении свойств растворов электролитов и неэлектролитов.
Свойства растворов, которые не зависят от природы растворенного вещества, а определяются числом частиц в растворе называются коллигативными свойствами. К ним относят понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора и явление осмоса.
ПОНИЖЕНИЕ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА РАСТВОРИТЕЛЯ НАД РАСТВОРОМ.
Давление пара растворов ниже давления пара чистых растворителей при той же температуре. Понижение давления пара объясняется тем, что поверхность раствора частично занята сольватированными молекулами растворенного вещества, за счет чего уменьшается молярная доля самого растворителя, а следовательно и давление его насыщенного пара над раствором. Насыщенным называется пар, находящийся в равновесии с жидкостью или твердым телом.
Согласно закону Рауля давление насыщенного пара растворителя над разбавленным раствором равно:
РА=Р0АХА (1), где
РА – давление насыщенного пара над раствором;
Р0А – давление насыщенного пара над чистым растворителем;
ХА – молярная доля растворителя в растворе.
Для раствора, состоящего из двух компонентов А и В, сумма молярных долей равна
ХА+ХВ=1
Следовательно, ХА=1-ХВ
Подставив это выражение в (1), получают
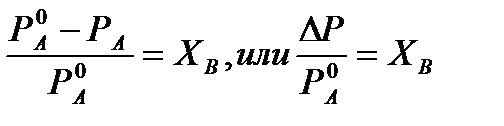 (2)
(2)
Выражение (2) называют второй формой закона Рауля: относительное понижение давления ( 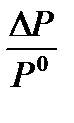 )насыщенного пара растворителя над разбавленным раствором нелетучего вещества равно молярной доле растворенного вещества.
)насыщенного пара растворителя над разбавленным раствором нелетучего вещества равно молярной доле растворенного вещества.
Молярная доля растворенного вещества определяется следующим соотношением:
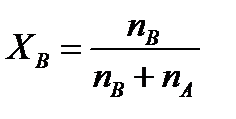
nB – число молей растворенного вещества,
nA – число молей растворителя.
При значительном разведении раствора, когда nA>>nB, можно пренебречь в знаменателе величиной nB и тогда
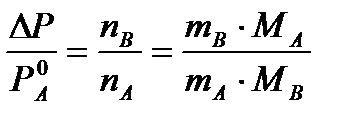 (2а)
(2а)
Уравнение (2а) можно использовать для определения молярной массы растворенного вещества.
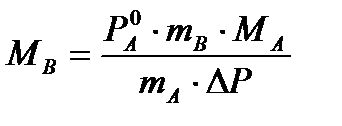 , где
, где
mA – масса растворителя
mB – масса растворенного вещества
MA – молярная масса растворителя
MB – молярная масса растворенного вещества
Растворы, подчиняющиеся закону Рауля, получили название идеальных растворов. Таких растворов очень мало, однако в разбавленных растворах отклонение от законов Рауля незначительны и ими можно пренебречь и считать такие растворы идеальными.
Разность давления пара над раствором и растворителем невелика и неудобна для экспериментальных определений с большой точностью. Гораздо легче измерить другие величины, находящиеся в зависимости от понижения давления пара, как, например, изменение температуры кипения и замерзания раствора по сравнению с соответствующими величинами для чистого растворителя.
