Коллигативные свойства разбавленных растворов неэлектролитов
Коллигативными называются свойства, величина которых зависит только от количества частиц растворённого вещества. Измеряя одно из этих свойств можно вычислить все остальные. К количественным свойствам относятся: 1) понижение Р пара растворителя над раствором 2) повышение Т кипения разбавленного раствора по сравнению с температурой кипения чистого растворителя 3) понижение Т замерзания раствора по сравнению с Т замерзания чистого растворителя 4) осмотическое Р при постоянной Т давления насыщенного пара растворителя над раствором всегда ниже чем давление насыщенного пара над чистым растворителем 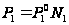 ,
, 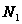 – молярная доля растворителя в растворе
– молярная доля растворителя в растворе 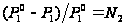 . Относительное понижение давление пара растворителя над раствором равно молярной доле растворённого вещества. З. Рауля можно вывести используя Ур Дюгема – Маргулиса. Запишем закон Генри выражение концентрации
. Относительное понижение давление пара растворителя над раствором равно молярной доле растворённого вещества. З. Рауля можно вывести используя Ур Дюгема – Маргулиса. Запишем закон Генри выражение концентрации 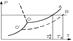 растворённого вещества в молярных долях
растворённого вещества в молярных долях 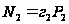 ,
, 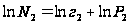 ;
;
продифференцировав по 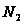 при постоянстве Р и Т
при постоянстве Р и Т 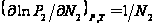 (1).
(1).
В соотв. Ур Д – М.
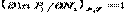 ,
, 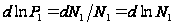 (2),
(2), 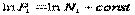 ,
, 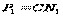 ,
, 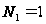 , то
, то 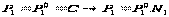
растворы кипят при Т более высокой чем чистый растворитель. Любая жидкость начинает кипеть при такой температуре, при которой давление её насыщенного пара становится равным внешнему давлению. В соответствии с з Рауля давление пара над раствором ниже, чем над чистым растворителем при той же температуре. Равенство давлений внешнего и пара над раствором достигается при более высокой Т.
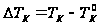 ,
, 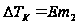 ,
, 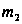 - моляльность, Е – эбуллиоскопическая константа, ОА – зависимость Р от Т для чистого растворителя, O’B– для раствора. Эбуллиоскопическая константа = повышению температуры кипения раствора в котором концентрация растворённого вещества = 1 моль/кг растворителя. При условии, что раствор сохраняет свойства разбавленного. Эбулеоскопической константой называется молярное повышение Т кипения. Е как и К зависит только от природы растворителя
- моляльность, Е – эбуллиоскопическая константа, ОА – зависимость Р от Т для чистого растворителя, O’B– для раствора. Эбуллиоскопическая константа = повышению температуры кипения раствора в котором концентрация растворённого вещества = 1 моль/кг растворителя. При условии, что раствор сохраняет свойства разбавленного. Эбулеоскопической константой называется молярное повышение Т кипения. Е как и К зависит только от природы растворителя 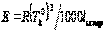 ,
, 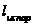 – удельная теплота испарения растворителя. Измеренным
– удельная теплота испарения растворителя. Измеренным 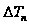 можно
можно  вычислить молекулярную массу растворено го вещества
вычислить молекулярную массу растворено го вещества 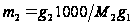 ,
, 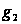 – масса растворённого вещества,
– масса растворённого вещества, 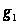 – масса растворителя
– масса растворителя 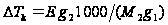 .
. 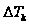 как правило < чем. точность определения молекулярной массы в значительной степени зависит от точного определения
как правило < чем. точность определения молекулярной массы в значительной степени зависит от точного определения 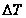 , то криоскопический метод является более предпочтительным.
, то криоскопический метод является более предпочтительным.
Любая жидкость начинает замерзать при такой Т при которой Р её насыщенного пара становится = давлению пара над твёрдым веществом. Т кристаллизации растворителя из раствора всегда ниже, чем Т кристаллизации чистого растворителя. 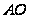 – зависимость Р над тв веществом,
– зависимость Р над тв веществом, 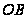 – Р пара над жидкостью.
– Р пара над жидкостью. 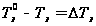 Установлено, что
Установлено, что 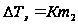 ,
, 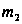 - моляльная концентрация растворённого вещества,
- моляльная концентрация растворённого вещества, 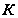 - коэффициент пропорциональности. Это соотношение получается следующим образом. Запишем Ур Клауз-Клап для растворителя в тв и ж сост.
- коэффициент пропорциональности. Это соотношение получается следующим образом. Запишем Ур Клауз-Клап для растворителя в тв и ж сост. 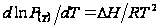 (1),
(1), 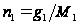 ,
, 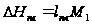 ,
, 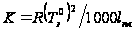 численно равно понижению Т замерзания раствора 1 моляльной концентрации. Измеренной
численно равно понижению Т замерзания раствора 1 моляльной концентрации. Измеренной 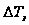 раствора определённой концентрации можно вычислить молекулярную массу растворённого вещества
раствора определённой концентрации можно вычислить молекулярную массу растворённого вещества 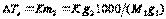 .
.
Если раствор привести в контакт с чистым растворителем, через полупроницаемую мембрану способную пропускать только молекулы растворителя, то наблюдается самопроизвольный переход растворителя в раствор, это явление называется осмосом. Давление, с которым растворитель стремится перейти в раствор называется осмотическим давлением. По величине это давление = тому давлению, которое нужно приложить к раствору, что бы прекратить переход растворителя в раствор (чтобы привести его в равновесие). Для разбавленных растворов неэлектролитов Ванд Гофф нашел 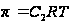 . Осмотическое давление может иметь большие величины
. Осмотическое давление может иметь большие величины 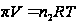 . Это давление, которое производили бы молекулы находящиеся в состоянии идеального газа и занимая при той же температуре V=V раствора. Осмотическое давление учитывается в технологических процессах переработки растительного и животного сырья.
. Это давление, которое производили бы молекулы находящиеся в состоянии идеального газа и занимая при той же температуре V=V раствора. Осмотическое давление учитывается в технологических процессах переработки растительного и животного сырья.
Закон Рауля.Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.
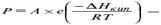
15 вопрос
Следствия из закона Рауля:1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
?tкип=Э x Смоляльн,
где Э – эбуллиоскопическая константа, +0,52.
?tзам=К x Смоляльн,
где К – криоскопическая константа, равная –1,86.
Эбуллиоскопическая константа – разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа – разница между температурой замерзания раствора и температурой чистого растворителя.
Для решения задач об этих константах необходимо знать массу растворенного вещества и массу раствора. Например, масса хлороформа (трихлорметан CHCl3) рассчитывается по формуле:
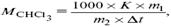
где m1 – масса растворенного вещества;
m2 – масса растворителя;
?t – величина, показывающая на сколько градусов понизилась температура;
К – криоскопическая константа.
16 вопрос
Осмос– явление селективной диффузии определенного сорта частиц через полупроницаемую перегородку. Это явление впервые описал аббат Нолле в 1748 г. Перегородки, проницаемые только для воды или другого растворителя и непроницаемые для растворенных веществ, как низкомолекулярных, так и высокомолекулярных, могут быть изготовлены из полимерных пленок (коллодия) или гелеобразных осадков, например, ферроцианида меди Cu2[Fe(CN)6]; этот осадок образуется в порах перегородки стеклянного фильтра при погружении пористого материала сначала в раствор медного купороса (CuSO4 x 5H2O), а затем желтой кровяной соли K2[Fе(CN)6] . Вещества диффундируют через такую перегородку, что является важным случаем осмоса, позволяющим измерять осмотическое дав-ление, т. е. осмотическое давление– мера стремления растворенного вещества перейти вследствие теплового движения в процессе диффузии из раствора в чистый растворитель; распределяется равномерно по всему объему растворителя, понизив первоначальную концентрацию раствора.
За счет осмотического давления сила заставляет жидкость подниматься вверх, это осмотическое давление уравновешивается гидростатическим давлением. Когда скорости диффундирующих веществ станут равны, тогда осмос прекратится.
Закономерности:
1. При постоянной температуре осмотическое давление раствора прямо пропорционально концентрации растворенного вещества.
2. Осмотическое давление пропорционально абсолютной температуре.
В 1886 г. Я. Г. Вант-Гофф показал, что величина осмотического давления может быть выражена через состояние газа
PоснV = RT.
закон Вант-Гоффа: осмотическое давление раствора численно равно тому давлению, которое производило бы данное количество растворенного вещества, если бы оно в виде идеального газа занимало при данной температуре объем, равный объему раствора.Все описанные законы относятся к бесконечно разбавленным растворам.Парциальное давление– то давление, которое оказывал бы газ, входящий в газовую смесь, если бы из нее были удалены все остальные газы при условии сохранения постоянными температуры и объема.Общее давление газовой смеси определяется законом Дальтона: общее давление смеси газов, занимающих определенных объем, равно сумме парциальных давлений, которыми обладал бы каждый отдельно взятый газ, если бы он занимал объем, равный объему смеси газов.Р = Р1 + Р2 + Р3 + … + Рк,где Р – общее давление;Рк – парциальное давление компонентов.
17 вопрос
Изотонические растворы – это особая группа растворов, которые характеризуются осмотическим давлением. Оно имеет такое значение, которым характеризуются жидкости в организме, как то: плазма крови, слезы, лимфа и так далее. Все эти жидкости имеют постоянноем давление в области 7,4 атм. При этом, если в организм будет введена инъекция, то осмотическое давление жидкостей будет нарушено, так как будет нарушено аналогичное равновесие.
Для того чтобы приготовить такой раствор, необходимо произвести некоторые расчеты. Самым известным способом их проведения является не что иное, как изотонический коэффициент Вант Гоффа. С его помощью можно рассчитать изотоническую концентрацию раствора разбавленного вещества, которое не является электролитом. Осмотическое давление, количество раствора, а также его температура находятся в определенной зависимости, которая выражается уравнением Клайперона. Его используют в отношении разбавленных растворов, так как согласно закону Вант Гоффа, вещества, растворенные в жидкости, будут вести себя так же, как и газы, а потому по отношению к ним применимы все так называемые газовые законы.
Изотонический коэффициент – это не что иное, как параметр, который будет характеризовать поведение вещества в каком-либо растворе. Если говорить о численном эквиваленте, то изотонический коэффициент равен отношению численного значения коллигативного свойства, которым обладает раствор, к такому же свойству неэлектролита, причем той же концентрации, при этом все прочие параметры остаются неизменными.
Физический смысл изотонического коэффициента становится понятным, исходя из определения каждого коллигативного параметра. Все они находятся в зависимости от концентрации вещества в растворе частиц. Неэлектролиты не будут вступать в реакции диссоциации, поэтому каждая отдельная молекула такого вещества будет представлять собой одну частицу. Электролиты же в процессе сольвации будут либо полностью, либо частично распадаться на ионы, при этом образуя несколько частиц. Получается, что и коллигативные свойства раствора будут зависеть от количества содержащихся в нем частиц разных типов, то есть ионов. Таким образом, изотонический коэффициент будет представлять собой смесь разных растворов каждого типа частиц. Если рассмотреть раствор хлорной извести, то можно увидеть, что он состоит из трех видов частиц: катионы кальция, гипохлорит, а также хлорид – анионы. Изотонический коэффициент будет показывать, что в растворе электролита имеется больше частиц, нежели в растворе неэлектролита. Коэффициент будет напрямую зависеть от того, может ли вещество распадаться на ионы – это не что иное, как свойство диссоциации.
Изотонический коэффициент – это не что иное, как параметр, который будет характеризовать поведение вещества в каком-либо растворе. Если говорить о численном эквиваленте, то изотонический коэффициент равен отношению численного значения коллигативного свойства, которым обладает раствор, к такому же свойству неэлектролита, причем той же концентрации, при этом все прочие параметры остаются неизменными.
Физический смысл изотонического коэффициента становится понятным, исходя из определения каждого коллигативного параметра. Все они находятся в зависимости от концентрации вещества в растворе частиц. Неэлектролиты не будут вступать в реакции диссоциации, поэтому каждая отдельная молекула такого вещества будет представлять собой одну частицу. Электролиты же в процессе сольвации будут либо полностью, либо частично распадаться на ионы, при этом образуя несколько частиц. Получается, что и коллигативные свойства раствора будут зависеть от количества содержащихся в нем частиц разных типов, то есть ионов. Таким образом, изотонический коэффициент будет представлять собой смесь разных растворов каждого типа частиц. Если рассмотреть раствор хлорной извести, то можно увидеть, что он состоит из трех видов частиц: катионы кальция, гипохлорит, а также хлорид – анионы. Изотонический коэффициент будет показывать, что в растворе электролита имеется больше частиц, нежели в растворе неэлектролита. Коэффициент будет напрямую зависеть от того, может ли вещество распадаться на ионы – это не что иное, как свойство диссоциации.
Так как сильные электролиты полностью подвергаются процессам диссоциации, то вполне оправданно ожидать, что изотонический коэффициент в данном случае будет равен количеству ионов, содержащихся в молекуле. Однако в реальности значение коэффициента будет всегда меньше, чем значение, расчитанное по формуле. Данная позиция обоснована еще в 1923 году Дебаем и Хюккелем. Они сформулировали теорию сильных электролитов: ионы не будут с препятствиями передвигаться, так как будет образовываться оболочка сольвации. Более того, они еще будут и взаимодействовать друг с другом, что приведет, в конце концов, к образованию такой их группы, которая будет передвигаться в одном направлении по раствору. Это и есть так называемые ионные ассоциации, а также ионные пары. Все процессы в растворе будут происходить таким образом, как будто в нем содержится мало частиц.
Взаимодействие ионов начнет ослабевать по мере того, как будет повышаться температура, а также уменьшаться их концентрация. Все объясняется тем, что в таком случае уменьшится и вероятность встречи разных частиц в растворе.
18 вопрос
?????
Согласно общепринятому определению, Изоосмия, изотония (от изо... и греч. osmós - толчок, tónos - напряжение), относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: электролитов, белков и т. д. И. - одна из важнейших физиологических констант организма, обеспечиваемых механизмами саморегуляции (см. Гомеостаз (см. Гомеостаз)). Отклонение осмотического давления от нормального физиологического уровня " 0,76-0,81 Мн/м2(7,6-8,1 ат) влечёт за собой нарушение обменных процессов между кровью и тканевой жидкостью.
Осмолярность - это концентрация активных частиц в 1 кг воды. Осмолярность внутриклеточной жидкости всегда равна осмолярности внеклеточной жидкости и, в частности, осмолярности плазмы крови. Поэтому с диагностической целью обычно достаточно исследовать осмолярность или осмоляльность плазмы. Осмолярность плазмы определяется количеством диссоциированных молекул электролитов (ионов), преимущественно натрия, недиссоциированных молекул (глюкоза, мочевина), белка. Осмолярность плазмы = 2х(К+Ыа)+глюкоза+мочевина+(белокх 0,243)
где осмолярность - мОсм/кг, К, Ыа, глюкоза, мочевина - ммоль/л, белок - г/л
В клинической практике чаще исследуют осмоляльность биологической жидкости - осмотическое давление биологической жидкости, свободной от белков, и зависящее от количества ионов, глюкозы и мочевины или рассчитать этот показатель по формуле:
Осмоляльность плазмы = 2Х(К+Ыа)+глюкоза+мочевина где осмоляльность - мОсм/кг, К, Ыа, глюкоза, мочевина - ммоль/л.
Вопрос
Роль осмоса и осмотического давления в биологических системах
Явление осмоса играет важную роль во многих хими–ческих и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточ–ные структуры. Упругость клеток (тургор), обеспечиваю–щая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойст–вами полупроницаемых мембран. При помещении этих клеток в растворы с различной концентрацией наблю–дается осмос.
Растворы, имеющие одинаковое осмотическое дав–ление, называются изотоническими. Если два раство–ра имеют различное осмотическое давление, то раствор с большим осмотическим давлением является гиперто–ническим по отношению ко второму, а второй – гипото–ническим по отношению к первому. При помещении кле–ток в изотонический раствор они сохраняют свой размер и нормально функционируют.
При помещении клеток в гипотонический раствор во–да из менее концентрированного внешнего раствора пе–реходит внутрь клеток, что приводит к их набуханию, а затем к разрыву оболочек и вытеканию клеточного со–держимого. Такое разрушение клеток называется лизи–сом, в случае эритроцитов этот процесс называется ге–молизом. Кровь с клеточным содержимым, выходящим наружу при гемолизе, за свой цвет называется лаковой кровью.
При помещении клеток в гипертонический раствор во–да из клеток уходит в более концентрированный раст–вор, и наблюдается сморщивание (высушивание) кле–ток. Это явление называется плазмолизом.
Биологические жидкости человека (кровь, лимфа, тка–невые жидкости) представляют собой водные растворы низкомолекулярных соединений – NaCI, KCl, СаС1, высокомолекулярных соединений – белков, поли–сахаридов, нуклеиновых кислот и форменных элемен–тов – эритроцитов, лейкоцитов, тромбоцитов. Их суммар–ным действием определяется осмотическое давление биологических жидкостей.
Явление осмоса широко используют в медицинской практике. Так, в хирургии применяют гипертонические по–вязки (марлю, смоченную в гипертоническом 10%-ном рас–творе NaCl), которые вводят в гнойные раны.
По закону осмоса ток жидкости раны через марлю направляется наружу, в результате чего рана постоян–но очищается от гноя, микроорганизмов и продуктов распада.
Плазмолиз- (plasmolysis) - протекающий в организме бактерий и растений процесс, который характеризуется отслаиванием протоплазмы от плотной клеточной стенки при помещении клетки в гипертонический раствор. Плазмолиз протекает благодаря удалению из клетки воды за счет осмоса.;
Цитолиз - (cytolysis) - разрушение клеток, особенно их плазмалеммы.;
Вопрос
Буферные системы
Буферные системы их классификация и механизм действия. Емкость буферных систем.
Буферными системами (буферами) называют растворы, обладающие свойством достаточно, стойко, сохранять постоянство - концентрации водородных ионов как при добавлении кислот или щелочей, так и при разведении. Буферные системы (смеси или растворы) по составу бывают двух основных типов: а) из слабой кислоты и ее соли, образованной сильным основанием; б) из слабого основания и его соли, образованной сильной кислотой. На практике часто применяют следующие буферные смеси: ацетатный буфер CH3COOH + CH3COONa, бикарбонатный буфер H2CO3+NaHCO3, аммиачный буфер NH4OH +NH4Cl, белковый буфер белок кислота + белок соль, фосфатный буфер NaH2PO4 + Na2 HPO4Фосфатная буферная смесь состоит из двух солей, одна из которых является однометаллической, а вторая - двухметаллической солью фосфорной кислоты. Ацетатный буфер. Рассмотрим механизм буферного действия. При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие с одним из компонентов смеси (СНзСООН); Из уравнения (а), сильная кислота заменяется эквивалентным количеством слабой кислоты (в данном случае НСl заменяется СН3СООН). В соответствии с законом разведения Оствальда повышение концентрации уксусной кислоты понижает степень ее диссоциации, а в результате этого концентрация ионов Н+ в буфере увеличивается незначительно. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера, (СН3СООН) по реакции нейтрализации. В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей — степени влияющей на реакцию среды. Анионы СНзСОО~, образующиеся при диссоциации этой соли, будут оказывать некоторое Угнетающее действие на диссоциацию уксусной кислоты. Буферной емкостью (В) называется количество сильной кислоты или сильного основания, которое нужно прибавить к одному литру буферного раствора, чтобы изменить его рН на единицу. Она выражается в моль/л или чаще в ммоль/л и определяется по формуле: В = (c V) / д pH Vб , где В - буферная емкость; с - концентрация сильной кислоты или основания (моль/л); V - объем добавленного сильного электролита (л); Vб - объем буферного раствора (л); д рН - изменение рН.
