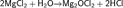Взаимодействие с металлами
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): 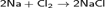
Взаимодействие с неметалламиC неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды. 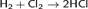
Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение. Может быть получен при взаимодействии перманганата калия с соляной кислотой:
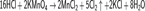
Метод Шееле
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:
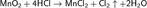
Метод Дикона
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
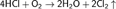
Электрохимические методы
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли, основные процессы которого можно представить суммарной формулой:
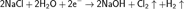
Степени окисления7, 6, 5, 4, 3, 1, −1.
№37галогеноводороды. Качественные реакции на галогенид-ионы.
Все галогеноводороды — бесцветные газы с резким запахом, хорошо растворимые в воде. На воздухе их концентрированные растворы дымят вследствие выделения галогеноводородов. Химические свойства: Галогеноводороды хлора, брома, йода при обычных условиях — газы. Хорошо растворимы в воде, при растворении протекают следующие процессы:  Галогены в галогеноводородах имеют степень окисления −1. Могут выступать в качестве восстановителей, причём восстановительная способность в ряду HCl — HBr — HI увеличивается:
Галогены в галогеноводородах имеют степень окисления −1. Могут выступать в качестве восстановителей, причём восстановительная способность в ряду HCl — HBr — HI увеличивается: 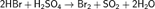

Получения
Вытеснение из солей сильными кислотами: 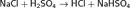
Качественные реакции на галогенид – ионы
Ag+ + Cl- =AgCl↓ белый творожистый
Ag+ + Br- = AgBr↓ светло-желтый
Ag+ + I- = AgI↓ желтый
№38 Соляная кислота: получение, свойства, хлориды. качественная реакция на хлорид-ион.
Химические свойства: Mg + 2НСl = MgCl2+ H2
Na2O + 2НСl = 2NaCl + H2O
Сu(ОН)2 + 2НСl = СuСl2 + 2H2O
Pb(NO3)2 + 2НСl = PbCl2+ 2НNО3
Получение:
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии крепкой серной кислоты на поваренную соль:

При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:

Возможно получение путем гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
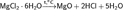
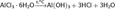
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например: