Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
5.16; 5.52; 5.53; 5.60; 5.67; 5.69; 5.70; 5.72; 5.75
5.102; 5.106; 5.107; 5.120; 5.126 ; 5.128; 5.129; 5.131; 5.135
Тема: Свойства буферных растворов.
 Лабораторная работа.
Лабораторная работа.
Свойства буферных растворов, определение буферной емкости.
Цель:научиться готовить буферные растворы и исследовать зависимость рН буферного раствора от концентраций и соотношений концентраций компонентов буферной системы.
 Задание:приготовить буферные растворы с заданным значением pH, колориметрическим методом определить значение pH буферного раствора, определить буферную емкость, установить зависимость буферной емкости от разбавления, определить как влияет добавление небольших количеств сильных кислот и оснований на рН буферного раствора.
Задание:приготовить буферные растворы с заданным значением pH, колориметрическим методом определить значение pH буферного раствора, определить буферную емкость, установить зависимость буферной емкости от разбавления, определить как влияет добавление небольших количеств сильных кислот и оснований на рН буферного раствора.
Оборудование:спектрофотометр ПЭ-5300В с набором кювет, штатив с пробирками, стеклянные палочки, бюретки вместимостью 25 мл, градуированные пипетки, капельницы, воронки. Спектрофотометр ПЭ-5300В:
Реактивы:соляная кислота, растворы уксусной кислоты, ацетата натрия, гидроксида натрия (все с = 0,1 моль/л), раствор хлорида натрия 0,9%-й, растворы лакмоида, метилового оранжевого и метилового красного.
Сущность работы: Для расчета рН ацетатной буферной системы используют уравнение:
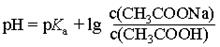 |
Анализ приведенного уравнения позволяет сделать следующие выводы: рН буферных растворов зависит от константы диссоциации сопряженной кислоты, от соотношения концентраций (количеств веществ) компонентов кислотно-основной пары, практически не зависит от разбавления раствора водой.
При введении в буферный раствор небольшого количества (X моль) сильной кислоты рН получившегося буферного раствора можно рассчитать следующим образом:
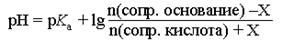 |
где n – количество вещества компонента буфера, моль.
При введении в буферный раствор небольшого количества (Y моль) сильного основания, рН буферного раствора можно рассчитать по формуле:
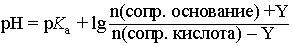 |
Выполнение эксперимента:
Опыт 1. Приготовление буферных растворов с различным значением рН.
а Приготовление буферных растворов с различным значением рН.
Экспериментальные данные
| Пробирка с исходным буферным раствором | №1 | №2 | №3 |
| с(NaCH3COO): с(CH3COOH) | |||
| Цвет буферного раствора после добавления лакмоида | |||
| рН исходного буферного раствора | |||
| Пробирка с разбавленным буферным раствором | №4 | №5 | №6 |
| с(NaCH3COO): с(CH3COOH) | |||
| Цвет разбавленного буферного раствора после добавления лакмоида | |||
| рН разбавленного буферного раствора |
Справочные данные: рКа(CH3COOH) = ________________
Расчет рН
Вывод (определяют зависимость рН буферного раствора от соотношения концентраций компонентов и от разбавления. Приводят объяснения):
_____________________
_____________________
_____________________
б) Колориметрическое определение рН буферного раствора.
Определяют рН приготовленного буферного раствора с помощью универсального индикатора. На полоску бумаги универсального индикатора стеклянной палочкой наносят 1 каплю исследуемого раствора. Полоску индикаторной бумаги сравнивают со стандартной шкалой рН.
Определение рН проводят на спектрофотометре ПЭ-5300В. В первую пробирку с помощью пипетки отмеривают 9,0 мл исследуемого буферного раствора. Во вторую пробирку добавляют из бюретки 9,0 мл раствора карбоната натрия. В обе пробирки добавляют точно (из бюретки) по 1,0 мл раствора выбранного индикатора. Содержимое пробирок хорошо перемешивают стеклянной палочкой. Одну из кювет заполняют раствором из первой пробирки, предварительно ополоснув ее этим раствором, другую кювету – дистиллированной водой. Растворы в кюветы наливают до метки. При необходимости внешние стенки кювет вытирают фильтровальной бумагой. Измеряют оптические плотности исследуемого раствора (Ax) и раствора карбоната натрия, в котором индикатор полностью ионизирован (Amах). Рассчитывают степень ионизации индикатора в исследуемом растворе.
 Экспериментальные данные:
Экспериментальные данные:
Приблизительное значение рН, рН = ___________
Выбранный индикатор: _______________________
Длина волны: λ = _______ нм
Значение оптической плотности: Ax = ___________ Amах = __________
Обработка результатов эксперимента:
Рассчитывают степень ионизации индикатора а в исследуемом растворе по формуле:
 α =
α = 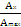 α =
α =
Рассчитывают значение рН по уравнению:
pH = pKa + lg 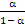 pH =
pH =
 |
Вывод:
_____________________
_____________________
_____________________
_____________________
_____________________
_

 Опыт 2. Выяснение влияния добавления небольших количеств сильных кислот и оснований на рН буферного раствора.
Опыт 2. Выяснение влияния добавления небольших количеств сильных кислот и оснований на рН буферного раствора.
 В пробирках 1 и 2 готовят по 10 мл буферного раствора с соотношением концентрации ацетата натрия и уксусной кислоты равным 2:3, для чего предварительно рассчитанные объемы растворов наливают из бюреток. В пробирки 3 и 4 отбирают с помощью пипетки по 10 мл физиологического раствора (0,9 %-го раствора хлорида натрия). Ко всем растворам добавляют по 5 капель раствора лакмоида. Содержимое пробирок перемешивают. Наблюдаемую окраску записывают в таблицу. При необходимости окраску физиологических растворов выравнивают, добавляя в пробирки 3 и 4 по каплям разбавленную соляную кислоту (с = 0,01 моль/л). После каждой добавленной капли кислоты раствор перемешивают стеклянной палочкой. В пробирки 1 и 3 добавляют по 5 капель раствора гидроксида натрия с концентрацией 0,1 моль/л. В пробирки 2 и 4 добавляют по 5 капель соляной кислоты с концентрацией 0,1 моль/л. Все растворы перемешивают и наблюдаемую окраску записывают в таблицу:
В пробирках 1 и 2 готовят по 10 мл буферного раствора с соотношением концентрации ацетата натрия и уксусной кислоты равным 2:3, для чего предварительно рассчитанные объемы растворов наливают из бюреток. В пробирки 3 и 4 отбирают с помощью пипетки по 10 мл физиологического раствора (0,9 %-го раствора хлорида натрия). Ко всем растворам добавляют по 5 капель раствора лакмоида. Содержимое пробирок перемешивают. Наблюдаемую окраску записывают в таблицу. При необходимости окраску физиологических растворов выравнивают, добавляя в пробирки 3 и 4 по каплям разбавленную соляную кислоту (с = 0,01 моль/л). После каждой добавленной капли кислоты раствор перемешивают стеклянной палочкой. В пробирки 1 и 3 добавляют по 5 капель раствора гидроксида натрия с концентрацией 0,1 моль/л. В пробирки 2 и 4 добавляют по 5 капель соляной кислоты с концентрацией 0,1 моль/л. Все растворы перемешивают и наблюдаемую окраску записывают в таблицу:
| № раствора | Объект изучения | Окраска раствора после добавления лакмоида | + 5 капель НСl, с = 0,1 моль/л | + 5 капель НСl, с = 0,1 моль/л |
| Буферный раствор | ______ | |||
| Буферный раствор | ______ | |||
| Физиологический раствор | ______ | |||
| Физиологический раствор | ______ |
 Вывод (кратко формулируют механизм буферного действия):
Вывод (кратко формулируют механизм буферного действия):
_____________________
_____________________
_____________________
_____________________
_____________________
