Эквиваленты и закон эквивалентов
121. Эквивалент - реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Эквивалентная масса - масса одного эквивалента вещества. Молярная масса эквивалента - масса одного моль эквивалентов. Эквивалентная масса (Mэ), валентность (В), атомная масса (А) элемента связаны соотношением: 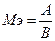
Например, валентность азота в аммиаке равна 3, следовательно, молярная масса эквивалента азота: Мэ(N) = 14/3 = 4,66 г/моль
122. 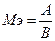 . Э(Li) в LiH=1, Мэ(Li)=39/1=39 г/моль; Э(Be) в BeH2 = 2 Мэ(Be)=9/2=4.5 г/моль; Э(В) в ВН3=3 Мэ(В)=11/3=3.66 г/моль; Э(С) в СН4=4 Мэ(С)=12/4=3 г/моль.
. Э(Li) в LiH=1, Мэ(Li)=39/1=39 г/моль; Э(Be) в BeH2 = 2 Мэ(Be)=9/2=4.5 г/моль; Э(В) в ВН3=3 Мэ(В)=11/3=3.66 г/моль; Э(С) в СН4=4 Мэ(С)=12/4=3 г/моль.
123.
| В-во | Эквивалент Cr | Эквивалентная масса Cr | Молярная масса экв-та Cr |
| CrO | 52/2=26 | 52/2=26 г/моль | |
| Cr2O3 | 52/3=17.3 | 52/3=17.3 г/моль | |
| CrO3 | 52/6=8.67 | 52/6=8.67 г/моль |
124.
| Вещество | Эквивалент V | Эквивалентная масса V | Молярная масса экв-та V |
| VO | 51/2=25.5 | 51/2=25.5 г/моль | |
| V 2O3 | 51/3=17 | 51/3=17 г/моль | |
| VO2 | 51/4=12.75 | 51/4=12.75 г/моль | |
| V2O5 | 51/5=10.2 | 51/5=10.2 г/моль |
125. Закон эквивалентов: для молекулярных соединений массовые количества составляющих элементов пропорциональны их химическим эквивалентам; при отсутствии молекулярной структуры массовые количества составляющих элементов могут отклоняться от значений их химических эквивалентов: 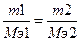 . m(Me)=16.74 г., m(MeO)=21.54 г., Мэ(МеО)=Мэ(Ме)+Мэ(О)=Мэ(Ме)+8.
. m(Me)=16.74 г., m(MeO)=21.54 г., Мэ(МеО)=Мэ(Ме)+Мэ(О)=Мэ(Ме)+8. 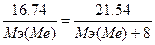 , следовательно, Мэ(Ме)=28 г/моль. Т.к. валентность=2, то атомная масса металла=28*2=56 - железо.
, следовательно, Мэ(Ме)=28 г/моль. Т.к. валентность=2, то атомная масса металла=28*2=56 - железо.
126. 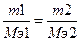 m(Sn)=0.92г., m(SnO)=1.17г., Мэ(SnО)=Мэ(Sn)+Мэ(О)=Мэ(Sn)+8.
m(Sn)=0.92г., m(SnO)=1.17г., Мэ(SnО)=Мэ(Sn)+Мэ(О)=Мэ(Sn)+8. 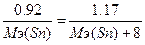 , следовательно, Мэ(Sn)=29.7 г/моль. Т.к. атомная масса олова=118.6, то валентность олова В=А/Мэ=118.6/29.7=4, следовательно, это SnO2.
, следовательно, Мэ(Sn)=29.7 г/моль. Т.к. атомная масса олова=118.6, то валентность олова В=А/Мэ=118.6/29.7=4, следовательно, это SnO2.
127. w%(O)=40.05%. Возьмем 100 грамм оксида, масса кислорода равна m(О)=40.05 грамм, масса металла m(Ме)=100-40.05=59.95г. 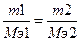 , следовательно,
, следовательно, 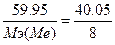 , Мэ(Ме)=12 г/моль. Т.к. валентность=4, то атомная масса металла=12*4=48 - титан TiO2.
, Мэ(Ме)=12 г/моль. Т.к. валентность=4, то атомная масса металла=12*4=48 - титан TiO2.
128. Объем кислорода равен V(О)=6.72 литра, масса металла m(Ме)=10.8г. 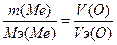 , следовательно,
, следовательно, 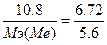 , Мэ(Ме)=9 г/моль. Т.к. валентность=3, то атомная масса металла=9*3=27 - алюминий.
, Мэ(Ме)=9 г/моль. Т.к. валентность=3, то атомная масса металла=9*3=27 - алюминий.
129. 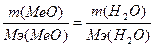 , следовательно,
, следовательно, 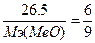 , Мэ(МеО) = 39.75 г/моль, Мэ(Ме) = Мэ(МеО)-Мэ(О)=39.75-8=31.75 г/моль. Т.к. валентность=2, то атомная масса металла = 31.75*2 = 63.5 - медь. CuO.
, Мэ(МеО) = 39.75 г/моль, Мэ(Ме) = Мэ(МеО)-Мэ(О)=39.75-8=31.75 г/моль. Т.к. валентность=2, то атомная масса металла = 31.75*2 = 63.5 - медь. CuO.
130. w%(Н) = 4.76%. Возьмем 100 грамм гидрида, масса водорода равна m(Н) = 4.76 г., масса металла m(Ме) = 100-4.76 = 95.24г. 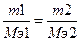 , следовательно,
, следовательно, 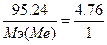 , Мэ(Ме) = 20 г/моль. Т.к. В = 2, то атомная масса металла = 20*2 = 40 - кальций СаH2.
, Мэ(Ме) = 20 г/моль. Т.к. В = 2, то атомная масса металла = 20*2 = 40 - кальций СаH2.
131. а) w%(O)=11.18%. Возьмем 100 грамм оксида, масса кислорода равна m(О)=11.18 грамм, масса меди m(Cu)=100-11.18=88.82г. 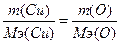 , следовательно,
, следовательно, 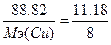 , Мэ(Cu)=63.5 г/моль. Т.к. атомная масса меди=63.5, то валентность=63.5/63.5=1 - Cu2O.
, Мэ(Cu)=63.5 г/моль. Т.к. атомная масса меди=63.5, то валентность=63.5/63.5=1 - Cu2O.
б) w%(O)=20.11%. Возьмем 100 грамм оксида, масса кислорода равна m(О)=20.11 грамм, масса меди m(Cu)=100-20.11=79.89г. 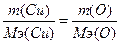 , следовательно,
, следовательно, 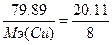 , Мэ(Cu)=31.6 г/моль. Т.к. атомная масса меди=63.5, то валентность=63.5/31.6=2 - CuO.
, Мэ(Cu)=31.6 г/моль. Т.к. атомная масса меди=63.5, то валентность=63.5/31.6=2 - CuO.
132. а) w%(O)=7.17%. Возьмем 100 грамм оксида, масса кислорода равна m(О)=7.17 грамм, m(Pb)=100-7.17=92.83г. 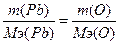 , следовательно,
, следовательно, 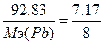 , Мэ(Pb)=103.6 г/моль. Т.к. атомная масса свинца=206.7, то валентность=206.7/103.6=2 - PbO.
, Мэ(Pb)=103.6 г/моль. Т.к. атомная масса свинца=206.7, то валентность=206.7/103.6=2 - PbO.
б) w%(O)=13.38%. Возьмем 100 грамм оксида, масса кислорода равна m(О)=13.38 грамм, m(Pb)=100-13.38=86.62г. 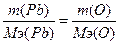 , следовательно,
, следовательно, 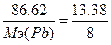 , Мэ(Pb)=51.8 г/моль. Т.к. атомная масса свинца=206.7, то валентность=206.7/51.8=4 - PbO2.
, Мэ(Pb)=51.8 г/моль. Т.к. атомная масса свинца=206.7, то валентность=206.7/51.8=4 - PbO2.
133. а) w%(F)=34.89%. Возьмем 100 грамм вещества, масса фтора равна m(F)=34.89 грамм, m(Cl)=100-34.89=65.11г. 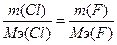 , следовательно,
, следовательно, 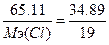 , Мэ(Cl)=35.5 г/моль. Т.к. атомная масса хлора=35.5, то валентность=35.5/35.5=1 - ClF.
, Мэ(Cl)=35.5 г/моль. Т.к. атомная масса хлора=35.5, то валентность=35.5/35.5=1 - ClF.
б) w%(F)=61.65%. Возьмем 100 грамм вещества, масса фтора равна m(F)=61.65 грамм, m(Cl)=100-61.65=38.35г. 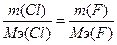 , следовательно,
, следовательно, 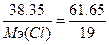 , Мэ(Cl)=11.8 г/моль. Т.к. атомная масса хлора=35.5, то валентность=35.5/11.8=3 - ClF3.
, Мэ(Cl)=11.8 г/моль. Т.к. атомная масса хлора=35.5, то валентность=35.5/11.8=3 - ClF3.
в) w%(F)=72.82%. Возьмем 100 грамм вещества, масса фтора равна m(F)=72.82 грамм, m(Cl)=100-72.82=27.18г. 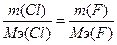 , следовательно,
, следовательно, 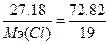 , Мэ(Cl)=7.1 г/моль. Т.к. атомная масса хлора=35.5, то валентность=35.5/7.1=5 - ClF5
, Мэ(Cl)=7.1 г/моль. Т.к. атомная масса хлора=35.5, то валентность=35.5/7.1=5 - ClF5
г) w%(F)=78.96%. Возьмем 100 грамм вещества, масса фтора равна m(F)=78.96 грамм, m(Cl)=100-78.96=21.04г. 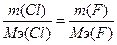 , следовательно,
, следовательно, 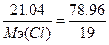 , Мэ(Cl)=5.1 г/моль. Т.к. атомная масса хлора=35.5, то валентность=35.5/5.1=7 - ClF7.
, Мэ(Cl)=5.1 г/моль. Т.к. атомная масса хлора=35.5, то валентность=35.5/5.1=7 - ClF7.
134. а) w%(S)=39.1%. Возьмем 100 грамм вещества, масса серы равна m(S)=39.1 грамм, В(S)=2, следовательно, Мэ(S)=32/2=16 г/моль. m(As)=100-39.1=60.9г. 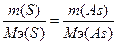 , следовательно,
, следовательно, 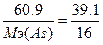 , Мэ(As)=24.9 г/моль. Т.к. атомная масса мышьяка = 75, то валентность=75/24.9=3 - As2S3.
, Мэ(As)=24.9 г/моль. Т.к. атомная масса мышьяка = 75, то валентность=75/24.9=3 - As2S3.
б) w%(S)=51.7%. Возьмем 100 грамм вещества, масса серы равна m(S)=51.7 грамм. В(S)=2, следовательно, Мэ(S)=32/2=16 г/моль. m(As)=100-51.7=48.3г. 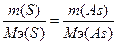 , следовательно,
, следовательно, 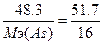 , Мэ(As)=15 г/моль. Т.к. атомная масса мышьяка = 75, то валентность=75/15=5 - As2S5.
, Мэ(As)=15 г/моль. Т.к. атомная масса мышьяка = 75, то валентность=75/15=5 - As2S5.
135. m(Г)=1.591г., V6(О)=70.2 мл. Известно, что Vэ(О)=5.6 л. По закону эквивалентов: 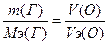 =>
=> 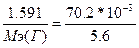 => Мэ(Г)=127 г/моль. А(Г)=127 а.е.м. Это иод.
=> Мэ(Г)=127 г/моль. А(Г)=127 а.е.м. Это иод.
136. m(Me) = 1.2 г., m(MeO) = 2 г., m(MeS) = 2.8 г. 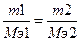 . Мэ(МеО) = Мэ(Ме) + Мэ(О) = Мэ(Ме) + 8.
. Мэ(МеО) = Мэ(Ме) + Мэ(О) = Мэ(Ме) + 8. 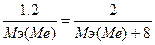 , следовательно, Мэ(Ме) = 12 г/моль. Мэ(МеS) = Мэ(Me) + Мэ(S) = Мэ(S) + 12.
, следовательно, Мэ(Ме) = 12 г/моль. Мэ(МеS) = Мэ(Me) + Мэ(S) = Мэ(S) + 12. 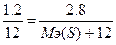 => Mэ(S) = 16 г/моль.
=> Mэ(S) = 16 г/моль.
137. Суд=0.218 Дж/(г.К). Мэ(Ме)=29.65 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 0.218 = 119.3 г/моль. Валентность металла: В(Ме) = А/Мэ = 119.3/29.65 = 4. Точная атомная масса равна А(Ме) = В*Мэ = 4*29.65 = 118.6 г/моль.
138. Суд=0.454 Дж/(г.К). w%(Me)=70.97%. Возьмем 100 грамм оксида. m(Me)=70.97 г., m(O)=100-70.97=29.03 г. 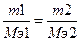 . Мэ(МеО) = Мэ(Ме) + Мэ(О) = Мэ(Ме) + 8.
. Мэ(МеО) = Мэ(Ме) + Мэ(О) = Мэ(Ме) + 8. 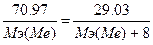 , следовательно, Мэ(Ме)=29.35 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 0.454 = 57.2 г/моль. Валентность металла: В(Ме) = А/Мэ = 57.2/29.35 = 2. Точная атомная масса равна А(Ме) = В*Мэ = 2*29.35 = 58.7 г/моль. - Ni.
, следовательно, Мэ(Ме)=29.35 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 0.454 = 57.2 г/моль. Валентность металла: В(Ме) = А/Мэ = 57.2/29.35 = 2. Точная атомная масса равна А(Ме) = В*Мэ = 2*29.35 = 58.7 г/моль. - Ni.
139. Суд=0.281 Дж/(г.К). m(Me)=0.6 г., m(МеO)=0.9 г. 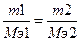 . Мэ(МеО) = Мэ(Ме) + Мэ(О) = Мэ(Ме) + 8.
. Мэ(МеО) = Мэ(Ме) + Мэ(О) = Мэ(Ме) + 8. 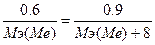 , следовательно, Мэ(Ме)=16 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 0.281 = 92.53 г/моль. Валентность металла: В(Ме) = А/Мэ = 92.53/16 = 6. Точная атомная масса равна А(Ме) = В*Мэ = 6*16 = 96 г/моль. - молибден. Погрешность=
, следовательно, Мэ(Ме)=16 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 0.281 = 92.53 г/моль. Валентность металла: В(Ме) = А/Мэ = 92.53/16 = 6. Точная атомная масса равна А(Ме) = В*Мэ = 6*16 = 96 г/моль. - молибден. Погрешность= 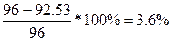
140. Суд=0.147 Дж/(г.К). m(Me)=0.2698 г., m(МеO)=0.3402 г. 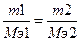 . Мэ(МеО) = Мэ(Ме) + Мэ(О) = Мэ(Ме) + 8.
. Мэ(МеО) = Мэ(Ме) + Мэ(О) = Мэ(Ме) + 8. 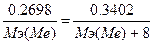 , следовательно, Мэ(Ме)=30.66 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 0.147 = 176.87 г/моль. Валентность металла: В(Ме) = А/Мэ = 176.87/30.66 = 6. Точная атомная масса равна А(Ме) = В*Мэ = 6*30.66 = 183.96 г/моль. - вольфрам.
, следовательно, Мэ(Ме)=30.66 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 0.147 = 176.87 г/моль. Валентность металла: В(Ме) = А/Мэ = 176.87/30.66 = 6. Точная атомная масса равна А(Ме) = В*Мэ = 6*30.66 = 183.96 г/моль. - вольфрам.
141. m(Me)=40 г., V(Н2)=14.6 л. T=18 oC=291 K, P=1.013*105 Па, Суд=0.39 Дж/(г.К). Найдем V(H2) при н. у.: 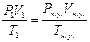 =>
=> 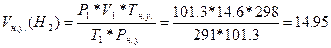 литров. Закон эквивалентов:
литров. Закон эквивалентов: 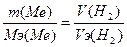 =>
=> 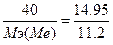 , Мэ(Ме)=32.71 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 0.39 = 66.67 г/моль. Валентность металла: В(Ме) = А/Мэ = 66.67/31.41 = 2. Точная атомная масса равна А(Ме) = В*Мэ = 2*32.71 = 65.42 г/моль. - цинк.
, Мэ(Ме)=32.71 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 0.39 = 66.67 г/моль. Валентность металла: В(Ме) = А/Мэ = 66.67/31.41 = 2. Точная атомная масса равна А(Ме) = В*Мэ = 2*32.71 = 65.42 г/моль. - цинк.
142. m(Me)=2.162 г., V(Н2)=14.78 л. T=327 oC=600 K, P=101.325*102 кПа, Суд=2.209 Дж/(г.К). 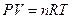 , следовательно,
, следовательно, 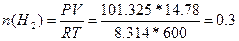 моль. Закон эквивалентов:
моль. Закон эквивалентов: 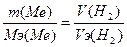 =>
=> 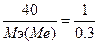 , Мэ(Ме)=12 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 2.209 = 11.77 г/моль. Валентность металла: В(Ме) = А/Мэ = 11.77/12 = 1. Точная атомная масса равна А(Ме) = В*Мэ = 1*12 = 12 г/моль. - углерод.
, Мэ(Ме)=12 г/моль. Закон Дюлонга-Пти: А(Ме)*Суд≈26. А(Ме) ≈ 26 / 2.209 = 11.77 г/моль. Валентность металла: В(Ме) = А/Мэ = 11.77/12 = 1. Точная атомная масса равна А(Ме) = В*Мэ = 1*12 = 12 г/моль. - углерод.
143. Эквивалентная масса кислоты равна отношению молярной массы кислоты к количеству замещаемых протонов: 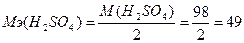 г/моль.
г/моль.
Эквивалентная масса основания равна отношению молярной массы основания к количеству замещаемых ОН-групп: 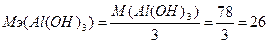 г/моль.
г/моль.
Эквивалентная масса соли равна отношению молярной массы соли к произведению количества катионов на их валентность: 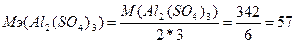 г/моль.
г/моль.
144. а) Н3РО4 + КОН = КН2РО4 + Н2О Мэ(Н3РО4)=М(Н3РО4)/Э=98/1=98 г/моль.
б) Н3РО4 + 2КОН = К2НРО4 + 2Н2О Мэ(Н3РО4)=М(Н3РО4)/Э=98/2=49 г/моль.
в) Н3РО4 + 3КОН = КН2РО4 + Н2О Мэ(Н3РО4)=М(Н3РО4)/Э=98/3=32.67 г/моль.
145. a) Fe(OH)3 + HCl = Fe(OH)2Cl + H2O Мэ(Fe(OH)3)=М(Fe(OH)3)/Э=107/1=107 г/моль.
б) Fe(OH)3 + 2HCl = Fe(OH)Cl2 + 2H2O Мэ(Fe(OH)3)=М(Fe(OH)3)/Э=107/2=53.5 г/моль.
в) Fe(OH)3 + 3HCl = Fe(OH)Cl3 + 3H2O Мэ(Fe(OH)3)=М(Fe(OH)3)/Э=107/3=35.67 г/моль.
146. a) NaHCO3 + NaOH = Na2CO3 + H2O Мэ(NaHCO3) = М(NaHCO3)/Э = 84/1 = 84 г/моль.
б) NaHCO3 + BaCl2 = BaCO3 + NaCl + HCl Мэ(NaHCO3) = М(NaHCO3)/Э = 84/2 = 42 г/моль.
147. m(щелочи) = 1.00 г, m(HCl) = 2.14 г. Мэ(щелочи) = ?. Закон эквивалентов: 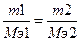 , следовательно, Мэ(щелочи) = m(щелочи)*Мэ(HCl)/m(HCl) = 1*36.5/2.14 = 17 г/моль.
, следовательно, Мэ(щелочи) = m(щелочи)*Мэ(HCl)/m(HCl) = 1*36.5/2.14 = 17 г/моль.
148. m(кислоты) = 0.18 г, m(NaOH) = 0.1 г. Мэ(кислоты) = ?. Закон эквивалентов: 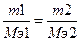 , следовательно, Мэ(кислоты) = m(кислоты)*Мэ(NaOH)/m(NaOH) = 0.18*40/0.1 = 72 г/моль.
, следовательно, Мэ(кислоты) = m(кислоты)*Мэ(NaOH)/m(NaOH) = 0.18*40/0.1 = 72 г/моль.
149. m(КОН)=14 г, m(H2SO4) = 24.5 г. Мэ(H2SO4)=?. Закон эквивалентов: 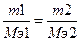 , следовательно, Мэ(H2SO4) = m(H2SO4)*Мэ(КОН)/m(КОН)=24.5*56/14=98 г/моль. Эквивалент H2SO4 равен 1, следовательно, образовалась однозамещенная соль (кислая) КНSO4
, следовательно, Мэ(H2SO4) = m(H2SO4)*Мэ(КОН)/m(КОН)=24.5*56/14=98 г/моль. Эквивалент H2SO4 равен 1, следовательно, образовалась однозамещенная соль (кислая) КНSO4
150. m(КОН)=1.291 г., m(H3PO3)=0.943 г. Мэ(H3PO3)=?. Закон эквивалентов: 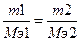 , следовательно, Мэ(H3PO3) = m(H3PO3)*Мэ(КОН)/m(КОН)=0.943*56/1.291=41 г/моль. Основность H3PO3 равна М(H3PO3)/Мэ(H3PO3)=82/41=2, следовательно, образовалась двузамещенная соль К2НРO3, данная кислота двухосновная, так как один атом водорода связан непосредственно с атомом фосфора и не способен замещаться на катионы.
, следовательно, Мэ(H3PO3) = m(H3PO3)*Мэ(КОН)/m(КОН)=0.943*56/1.291=41 г/моль. Основность H3PO3 равна М(H3PO3)/Мэ(H3PO3)=82/41=2, следовательно, образовалась двузамещенная соль К2НРO3, данная кислота двухосновная, так как один атом водорода связан непосредственно с атомом фосфора и не способен замещаться на катионы.
2КОН + H3PO3 = К2НРO3 + 2Н2О
