Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
Основные газовые законы. Определение молекулярных масс газообразных веществ.
Газовые законы - законы термодинамических процессов, протекающих в системе с неизменным количеством вещества при постоянном значении одного из параметров: закон Шарля, закон Гей-Люссака, закон Бойля-Мариотта, а также закон Авогадро, закон Дальтона.
Четыре первых закона вытекают из общего уравнения Менделеева-Клайперона 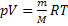 . Необходимо помнить и об уравнении Ван-дер-Ваальса, описывающем реальные газы. Закон Авогадро - закон идеальных газов, согласно которому в равных объемах различных газов при одинаковой температуре и давлении содержится одинаковое число молекул. Закон Бойля-Мариотта - закон идеальных газов, согласно которому для данной массы данного газа при постоянной температуре произведение давления на объем есть величина постоянная. Закон Бойля-Мариотта описывает изотермический процесс. Закон Гей-Люссака - закон идеальных газов, согласно которому объем данного количества газа при постоянном давлении прямо пропорционален абсолютной температуре. Закон Шарля - закон идеальных газов, согласно которому давление данной массы идеального газа при постоянном объеме прямо пропорционально абсолютной температуре. Закон Дальтона - физический закон, согласно которому давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов. При постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорциональна их парциальному давлению.
. Необходимо помнить и об уравнении Ван-дер-Ваальса, описывающем реальные газы. Закон Авогадро - закон идеальных газов, согласно которому в равных объемах различных газов при одинаковой температуре и давлении содержится одинаковое число молекул. Закон Бойля-Мариотта - закон идеальных газов, согласно которому для данной массы данного газа при постоянной температуре произведение давления на объем есть величина постоянная. Закон Бойля-Мариотта описывает изотермический процесс. Закон Гей-Люссака - закон идеальных газов, согласно которому объем данного количества газа при постоянном давлении прямо пропорционален абсолютной температуре. Закон Шарля - закон идеальных газов, согласно которому давление данной массы идеального газа при постоянном объеме прямо пропорционально абсолютной температуре. Закон Дальтона - физический закон, согласно которому давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов. При постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорциональна их парциальному давлению.
Основные стехиометрические законы.
1. Закон постоянства состава: в-во имеет постоянный состав независимо от способа его получения:
2H2+O2=2H2O и 4NH3+3O2=6H2O+2N. (состав H2O = const)
2.Закон эквивалентов: в-ва вступают в химическое взаимодействие и замещают друг друга в соединениях в весовых количествах пропорциональным химическим эквивалентам этих веществ.. Хим.эквивалент - это такое весовое кол-во в-ва, которое реагирует с 1.008 вес.част. H2 или 8 в.ч. О2.
3. Закон простых кратных отношений: если два элемента образуют несколько соединений, то на одно и тоже весовое кол-во одного элемента приходится такие весовые кол-ва др. Элемента, которые относятся между собой, как простые целые числа. Например, H20/H2O2 , CO/CO2, N2O/NO/N2O3/NO2/N2O4/N2O5.
Если в-во имеет молекулярную структуру (пар\газ\молек.крист.реш.) то все стехиометрические законы полностью выполняются, иначе - нет. Состав соединения зависит от условий получения.
Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
Эквивалентом называют условную или реальную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в ОВР. Эквивалентная масса элемента (вещества) определяется формулой Э=А/n, где А – масса одного моля элемента (вещества), n – его валентность. Закон химических эквивалентов – моль эквивалентов одного вещества реагирует с молем эквивалентов другого вещества.
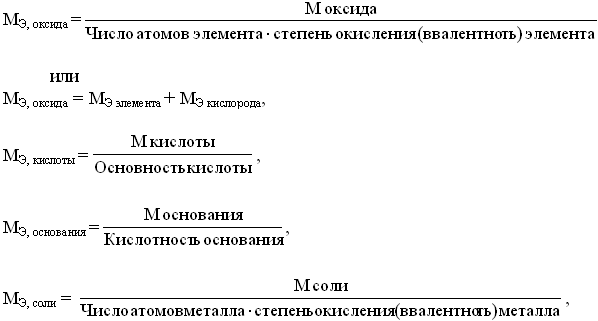
где М - мольная масса соединений;
