Основные положения теории Аррениуса
Теория Аррениуса включала следующие основные положения:
1. При растворении молекул неорганических и органических кислот, гидроксидов и солей распадаются (дисоциируют) на ионы:
HCl 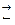 Н + + Cl –
Н + + Cl –
NaOH 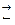 Na+ + OH–
Na+ + OH–
K2SO4 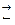 2K+ + SO42–
2K+ + SO42–
Ионы представляют собой заряженные частицы, которые состоят из отдельных атомов, или из группы атомов, или из группы атомов. Предполагалось, что ионы в растворе ведут себя подобно молекулам идеального газа, т.е. не взаимодействую друг с другом.
Физические причины, которые приводят к диссоциации, в теории Аррениуса не рассматривались. Не обсуждался также вопрос о том, почему заряженные частицы, на которые должны были бы распространяться законы электростатики, не взаимодействуют друг с другом в растворе.
2. Диссоциация молекул на ионы является неполной, т.е. не все молекулы электролита, а лишь некоторая их доля α, названная степенью диссоциации, распадается на ионы. Степень диссоциации связанная с коэффициентом Вант-Гоффа соотношением:
α = 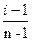 (1.1)
(1.1)
где, n – число ионов, на которое распадается одна молекула электролита.
Все качественные изменения, наблюдающиеся в растворах электролитов при увеличении или уменьшении концентрации, теория электролитической диссоциации связывает с изменением степени диссоциации.
Степень электролитической диссоциации рассматривается этой теорией как одна из основных количественных характеристик раствора электролита.
3. Между ионами и молекулами в растворе существует равновесие. К процессу электролитической диссоциации применим закон действующих масс и второй количественной характеристикой электролита является константа диссоциации.
Ее связь со степенью диссоциации можно рассмотреть на примере бинарного электролита МА, диссоциирующего по уравнению:
МА 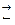 М+ + А–
М+ + А–
и поскольку СМА = С - Сα' = С(1-α),
а, 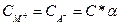 , то константа электролитической диссоциации К по теории Аррениуса должна быть заменена следующим выражением:
, то константа электролитической диссоциации К по теории Аррениуса должна быть заменена следующим выражением:
Кд = 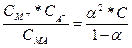 (1.2)
(1.2)
Данное уравнение было выведено В. Оствальдом и выражало сущность его закона разведения, поскольку обратная величина молярной концентрации υ = 1/С называется разведением.
Константа Кд для данного электролита по теории Аррениуса является постоянной и в отличие от степени диссоциации не должна зависеть от концентрации и определяется в первую очередь природой электролита. Поэтому, используя уравнение (1.2) можно рассчитать степень диссоциации электролита в зависимости от концентрации электролита.
Решая квадратное уравнение и учитывая, что α>0, получим:
α = 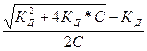 (1.3)
(1.3)
И как следует из уравнения (1.3), при С → 0 или К → ∞, α → 1 т.е. электролит становится полностью диссоциированным.
С другой стороны, при малых константах диссоциации и при не очень низких концентрациях электролита, когда К2 << 4КС
α ≈ 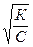 (1.4)
(1.4)
Соотношения (1.2) и (1.4) применимы только для бинарных электролитов.
