Тесты к теме: Закон эквивалентов. Титриметрия
1. Химический эквивалент – это:
а) всегда условная частица вещества;
б) условная или реальная частица вещества, в зависимости от вида
химической реакции, в которой оно участвует;
в) всегда реальная частица вещества;
г) более высокий уровень организации материи, чем атом или молекула.
2. Для одного и того же вещества, участвующего в разных химических реакциях:
а) соответствует один и тот же химический эквивалент;
б) химический эквивалент по своей природе всегда соответствует его молекуле или формульной единице;
в) соответствует несколько химических эквивалентов;
г) химический эквивалент всегда составляет какую-то определенную часть молекулы или формульной единицы.
3. Определить, какую именно часть молекулы составляет химический эквивалент вещества, можно:
а) только исходя из конкретной химической реакции, в которой это вещество участвует;
б) исходя из формулы вещества;
в) как правило, не предоставляется возможным;
г) на основании агрегатного состояния вещества.
4. Фактор эквивалентности - это:
а) стехиометрический коэффициент перед формулой вещества в уравнении реакции;
б) целое число, определённое опытным путём;
в) сумма стехиометрических коэффициентов, стоящих перед формулами веществ в уравнении химической реакции;
г) число, показывающее, какую часть реальной частицы вещества Х составляет его химический эквивалент.
5. Фактор эквивалентности вещества:
а) является безразмерной величиной;
б) определяется по формуле fэкв(Х) = 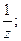
в) имеет размерность моль -1;
г) всегда определяется экспериментально.
6. Для HNO3, участвующей в реакции:
S + 6HNO3 → H2SO4 +6NO2 +2H2O
фактор эквивалентности равен:
а) 1/6;
б) 6;
в) 1;
г) 1/3.
7. Для H3PO4, участвующей в реакции:
H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O
фактор эквивалентности равен:
а) 1;
б) 2;
в) 1/3;
г) 1/2.
8. Для MnO4, участвующего в реакции:
2Mn+2 SO4 + 5NaBi+5O3 +16HNO3→ 2HMn+2O4 + 2Na2SO4 + 5Bi(NO3)3 +NaNO3+7 H2O
фактор эквивалентности равен:
а) 2;
б) 1/2;
в) 5;
г) 1/5;
9. Для Fe2(SO4)3, участвующего в реакции:
Fe2(SO4)3 + 6 KOH → 2Fe(OH)3 + 3 K2SO4
фактор эквивалентности равен:
а) 1;
б) 6;
в) 3;
г) 1/6.
10. Для H3PO4, участвующего в реакции:
H3PO3 + 2AgNO3 + H2O → H3PO4 + 2Ag + 2HNO3
фактор эквивалентности равен:
а) 1/2 ;
б) 1;
в) 2;
г) 6.
11. Дано превращение:
C2O42-→2CO20
фактор эквивалентности оксалат-иона равен:
а) 1;
б) 1/2;
в) 1/4;
г) 1/6.
12. Молярная масса химического эквивалента HNO2, участвующей в реакции:
HNO2 + Br2 + H2O → HNO3 + 2HBr равна:
а) 26 г/моль;
б) 28,5 г/моль;
в) 47 г/моль;
г) 94 г/моль.
13. Молярная масса химического эквивалента Ca(OH)2, участвующего в реакции:
2AlCl3 + 3Ca(OH)2 = 3CaCl2 + 2 Al(OH)3, равна:
а) 25 г/моль;
б) 37 г/моль;
в) 74 г/моль;
г) 148 г/моль.
14. Молярная масса химического эквивалента MnO2, участвующего в реакции:
3 MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O, равна:
а) 43,5 г/моль;
б) 87 г/моль;
в) 174 г/моль;
г) 435 г/моль.
15. Молярная масса химического эквивалента для KClO3, участвующего в
реакции:
3MnO2 + KClO3 + 6KOH ® 3K2MnO4 + KCl + 3H2O, равна:
а) 20,42;
б) 122,5;
в) 40,8;
г) 24,5.
16. В реакции
3NaOH + FeCl3 = 3 NaCl + Fe(OH)3
расходовалось 120 г NaOH. Количество эквивалента NaOH при этом составляет:
а) 9 моль;
б) 6 моль;
в) 3 моль;
г) 1 моль.
17. В реакции
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
расходовалось 126 г HNO3. Количество вещества эквивалента HNO3 при этом составляет:
а) 1 моль;
б) 3 моль;
в) 5 моль;
г) 6 моль.
18. В реакции
HNO2 + Br2 + H2O → HNO3 + 2HBr
расходовалось 94 г HNO2. Количество вещества эквивалента HNO2 при этом составляет:
а) 2 моль;
б) 4 моль;
в) 6 моль;
г) 7,5 моль.
19. В 5 дм3 раствора содержится 196 г H2SO4. Раствор необходим для осуществления реакции:
H2SO4 + K2S = K2SO4 + H2S,
молярная концентрация химического эквивалента H2SO4 в растворе равна:
а) 1,25 моль/дм3;
б) 2,5 моль/дм3;
в) 5 моль/дм3;
г) 7,5 моль/дм3.
20. В 2 дм3 раствора содержится 160 г Br2. Раствор необходим для осуществления реакции:
HNO2 + Br2 + H2O → HNO3 + 2HBr,
молярная концентрация химического эквивалента Br2 в растворе равна:
а) 0,5 моль/дм3;
б) 1 моль/дм3;
в) 2 моль/дм3;
г) 4 моль/дм3.
21. В 3 дм3 раствора содержится 126 г HNO3. Раствор необходим для осуществления реакции:
3Se + 4HNO3 + H2O → 3H2SeO3 +4NO,
молярная концентрация химического эквивалента HNO3 в растворе равна:
а) 0,5 моль/дм3;
б) 1 моль/дм3;
в) 1,5 моль/дм3;
г) 3 моль/дм3.
22. В 2 дм3 раствора содержится 196 г H3PO4. Раствор необходим для осуществления реакции:
H3PO4 + 3NaOH = Na3PO4 + 3H2O,
молярная концентрация химического эквивалента H3PO4 в растворе равна:
а) 0,33 моль/дм3;
б) 1 моль/дм3;
в) 2 моль/дм3;
г) 3 моль/дм3.
23. При взаимодействии H2SO4(конц.) с металлом выделился газ с плотностью
1,518 г/дм3. Фактор эквивалентности H2SO4 в этой реакции равен:
а) 1/2;
б) 1/4;
в) 1/8;
г) 2.
24. При взаимодействии H2S с HNO3(конц.) выделился газ, относительная плотность которого по водороду равна 23. Молярная масса эквивалента восстановителя (г/моль) равна:
а) 17;
б) 32;
в) 34;
г) 63.
25. Согласно закону эквивалентов, в химической реакции расходуются:
а) одинаковые массы исходных веществ;
б) одинаковые объёмы исходных веществ;
в) одинаковые химические количества исходных веществ;
г) одинаковые количества химических эквивалентов исходных веществ.
26. В титриметрическом анализе используется следующая математическая форма записи закона эквивалентов:
а) 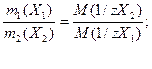
б) m1(X1) · M(1/zX1) = m2(X2) · M(1/zX2);
в) с/(1/zX1) · V1 = c/(1/zX2) · V2;
г) 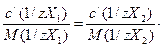
27. Титр показывает:
а) сколько граммов вещества содержится в 1см3 раствора;
б) сколько моль вещества содержится в 1 см3 раствора;
в) сколько граммов вещества содержится в 100 г раствора;
г) сколько моль вещества содержится в 100 г раствора.
28. На титрование 10 см3 исследуемого раствора затратили 25 см3 рабочего раствора с молярной концентрацией химического эквивалента вещества 0,02 моль/дм3. Молярная концентрация химического эквивалента вещества в исследуемом растворе равна:
а) 0,15 моль/дм3;
б) 0,5 моль/дм3;
в) 0,05 моль/дм3;
г) 0,025 моль/дм3.
29. На титрование 10 см3 0,1020 М раствора HCl пошло 12,5 см3 раствора КОН. Для раствора КОН будет верным:
а) титр КОН равен 0,00457 г/см3;
б) молярная концентрация КОН равна 0,0816 моль/дм3;
в) количество эквивалента вещества КОН в данной реакции равно
1,02 моль;
г) число формульных единиц КОН равно 0,614 · 1021.
30. В титриметрическом анализе титрантом называется:
а) исследуемый раствор;
б) рабочий раствор;
в) любой раствор, используемый для анализа;
г) раствор индикатора.
31. Точкой эквивалентности в титриметрии называется:
а) момент окончания реакции вследствие полного расходования обоих исходных веществ;
б) момент химической реакции, при котором массы расходованных исходных веществ равны друг другу;
в) момент химической реакции, при котором выполняется закон эквивалентов;
г) момент химической реакции, при котором объёмы использованных рабочего и исследуемого растворов равны друг другу.
32. Для определения точки эквивалентности в титриметрии используют:
а) кривые титрования;
б) растворы индикаторов;
в) зависимость скорости реакции от температуры;
г) зависимость скорости реакции от природы исходных веществ.
33. Кривые титрования показывают зависимость:
а) скорости химической реакции между титрантом и исследуемым веществом от времени;
б) концентрации определяемого вещества от объёма добавленного титранта;
в) какой-либо физической характеристики исследуемого раствора от объёма добавленного титранта;
г) концентрации исследуемого вещества от времени реакции.
34. В титриметрическом анализе может быть использована:
а) любая химическая реакция;
б) только окислительно-восстановительная реакция;
в) химическая реакция, которая соответствует предъявленным к ней требованиям;
г) только реакция ионного обмена.
35. Выберите правильные характеристики для кривых титрования:
а) скачок титрования не зависит от концентрации титруемого раствора и титранта;
б) вблизи точки эквивалентности наблюдается резкий скачок рН;
в) для фиксирования точки эквивалентности при кислотно-основном титровании можно использовать любой индикатор, интервал перехода окраски которого лежит в пределах скачка рН на кривой титрования;
г) при титровании сильной кислоты сильным основанием можно использовать только те индикаторы, у которых рТ=7.
36. Для кривых титрования в случае нейтрализации слабой кислоты сильным основанием выберите правильное утверждение:
а) начало кривой на оси ординат лежит при большем значении рН по сравнению с кривой титрования сильной кислоты сильным основанием;
б) точка эквивалентности не совпадает с нейтральной средой;
в) для определения точки эквивалентности следует выбирать индикатор метилоранж;
г) скачок титрования сужается и будет тем уже, чем слабее титруемая кислота.
37. Реакция, используемая в титриметрии, должна:
а) быть гомогенной;
б) быть гетерогенной;
в) протекать с достаточной скоростью, быть необратимой и однонаправленной, в ней должна быстро и точно фиксироваться точка эквивалентности;
г) быть только простой.
38. Способ титрования, при котором используется два рабочих раствора и один исследуемый, может быть:
а) только прямым;
б) как прямым, так и обратным;
в) обратным;
г) обратным или косвенным (иначе: метод замещения).
39. К требованиям, которым должны соответствовать реакции, используемые в титриметрии, относятся
а) реакция должна быть практически необратимой;
б) реакция должна протекать с достаточной скоростью;
в) реакция должна быть экзотермической;
г) в реакциях должна точно и быстро фиксироваться точка эквивалентности.
40. Закон эквивалентов для прямого титрования имеет вид:
а) N1V1 = N2V2;
б) с/(1/z Х1)·V1 = с/(1/z Х2)·V2;
в) N2V2= N1V1· N3V3;
г) с/(1/z Х2)·V2 = с/(1/z Х1)·V1+ с/(1/z Х3)·V3.
41. Закон эквивалентов для обратного титрования имеет вид:
а) N1V1 = N2V2;
б) с/(1/z Х1)·V1 = с/(1/z Х2)·V2;
в) N2V2= N1V1· N3V3;
г) с/(1/z Х2)·V2 = с/(1/z Х1)·V1+ с/(1/z Х3)·V3.
42. Закон эквивалентов для косвенного титрования имеет вид:
а) N1V1 = N2V2;
б) с/(1/z Х1)·V1 = с/(1/z Х2)·V2;
в) N2V2= N1V1· N3V3;
г) с/(1/z Х2)·V2 = с/(1/z Х1)·V1+ с/(1/z Х3)·V3.
43. При прямом титровании молярная концентрация химического эквивалента вещества в исследуемом растворе (N1) рассчитывается по формуле:
а) 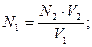
б) 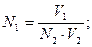
в) N1 = N2 · V2 ·V1;
г) 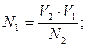
44. При обратном титровании молярная концентрация химического эквивалента вещества в исследуемом растворе (N1) рассчитывается по формуле:
а) 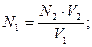
б) 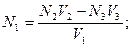
в) 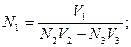
г) 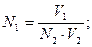
45. При косвенном или заместительном титровании:
а) используется только один рабочий раствор;
б) используются два рабочих раствора, один из которых берётся в избытке;
в) вещество исследуемого раствора с помощью химической реакции замешается на эквивалентное количество другого вещества;
г) используются три и более рабочих растворов.
46. В титриметрическом методе не может быть использована:
а) обратимая реакция;
б) сложная реакция, протекающая в несколько стадий;
в) реакция, состоящая из нескольких параллельных стадий, протекающих одновременно;
г) реакция, протекающая нестехиометрически.
47. Рабочим раствором в титриметрическом методе анализа называется:
а) любой используемый раствор;
б) раствор с неизвестной концентрацией растворённого вещества;
в) раствор, с помощью которого определяют концентрацию вещества в исследуемом растворе;
г) раствор с известной концентрацией растворённого вещества.
48. Для приготовления рабочего раствора нужной концентрации на основании точно взвешенной массы вещества может быть использовано:
а) любое твёрдое химическое соединение;
б) только то соединение, которое соответствует определённым требованиям;
в) вещество непостоянного состава с небольшой молекулярной массой;
г) только то соединение, водные растворы которого прозрачны.
49. Рабочим раствором с установлением титром называется:
а) раствор, приготовленный на основании теоретически рассчитанной и точно взвешенной навески исходного вещества;
б) раствор, точная концентрация которого устанавливается путём титрования после приготовления;
в) стандартизированный раствор;
г) исследуемый раствор, титр которого установлен.
50. Рабочим раствором с приготовленным титром называется:
а) раствор, приготовленный на основании теоретически рассчитанной и точно взвешенной навески исходного вещества;
б) раствор, точная концентрация которого устанавливается путём титрования после приготовления;
в) стандартный раствор;
г) исследуемый раствор, титр которого установлен.
51. Масса тетрабората натрия (Na2B4O7 · 10H2O), необходимая для приготовления 500 см3 0,1 н раствора (fэкв.=1/2) равна:
а) 4,789 г;
б) 9,55 г;
в) 19,10 г;
г) 355 г.
52. Ацидиметрией называется метод кислотно-основного титрования:
а) в котором в качестве рабочего раствора используют раствор кислоты;
б) в котором в качестве рабочего раствора используют раствор щелочи;
в) с помощью которого определяют количественное содержание основания в исследуемом растворе;
г) с помощью которого определяют количественное содержание кислоты в исследуемом растворе.
53. Алкалиметрией называют метод кислотно-основного титрования:
а) в котором в качестве рабочего раствора используют раствор кислоты;
б) в котором в качестве рабочего раствора используют раствор щелочи;
в) с помощью которого определяют количественное содержание основания в исследуемом растворе;
г) с помощью которого определяют количественное содержание кислоты в исследуемом растворе.
54. В ацидиметрии для стандартизации рабочих растворов используют:
а) Na2CO3;
б) щавелевую кислоту;
в) янтарную кислоту;
г) Na2B4O7·10H2O.
55. В алкалиметрии для стандартизации рабочих растворов используют:
а) Na2CO3;
б) щавелевую кислоту;
в) янтарную кислоту;
г) Na2B4O7·10H2O.
56. Точку эквивалентности в кислотно-основном титровании определяют:
а) инструментально, с помощью потенциометрических, кондуктометрических, спектрофотометрических, других измерений;
б) визуально, на основании изменения окраски раствора при титровании в присутствии индикаторов;
в) путём измерения затраченного объёма титранта;
г) на основании теоретических расчётов и полученных практических результатов.
57. Интервал перехода кислотно-основного индикатора – это:
а) область значений рН раствора, внутри которой происходит плавное изменение окраски индикатора;
б) время, за которое индикатор в растворе меняет свою окраску при добавлении сильной кислоты или щелочи;
в) тот минимальный объём раствора сильной кислоты, который нужно добавить к раствору индикатора, чтобы он изменил свою окраску на противоположную;
г) тот минимальный объём раствор щелочи, который нужно добавить к раствору индикатора, чтобы он изменил свою окраску на противоположную.
58. Точка эквивалентности совпадает с точкой нейтральности (рН = 7) на кривой титрования:
а) при титровании слабой кислоты сильным основанием;
б) при титровании сильной кислоты сильным основанием и наоборот;
в) всегда;
г) при титровании слабого основания сильной кислотой.
59. Точка эквивалентности лежит на кривой титрования при рН > 7 в случае:
а) титрования сильной кислоты сильным основанием и, наоборот;
б) титрования слабого основания сильной кислотой;
в) титрования слабой кислоты сильным основанием;
г) титрования слабого основания слабой кислотой.
60. Точка эквивалентности лежит на кривой титрования при рН < 7 в случае:
а) титрования сильной кислоты сильным основанием и, наоборот;
б) титрования слабого основания сильной кислотой;
в) титрования слабой кислоты сильным основанием;
г) титрования слабого основания слабой кислотой.
61. Интервал перехода для большинства кислотно-основных индикаторов равен:
а) 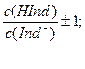
б) c(Ind-)/с (HInd)±1;
в) рKинд.±1;
г) Kинд.±1.
62. Величина интервала перехода кислотно-основного индикатора зависит от:
а) природы веществ в исследуемом и рабочем растворах;
б) особенностей структуры молекул индикатора;
в) величины Kинд.;
г) константы кислотности и константы основности веществ в исследуемом и рабочем растворах.
63. Внутренним кислотно-основным индикатором называется:
а) рабочий раствор, имеющий яркую окраску, исчезающую в конце титрования и используемый в качестве индикатора;
б) вещество, добавляемое в систему в конце титрования, и образующее с веществом рабочего раствора неустойчивое окрашенное соединение;
в) рабочий или исследуемый раствор, исчезновение яркой окраски которого свидетельствует о конце титрования;
г) индикатор, который вводится в систему перед началом процесса титрования.
64. Внешним кислотно-основным индикатором называется:
а) рабочий раствор, имеющий яркую окраску, исчезающую в конце титрования и используемый в качестве индикатора;
б) вещество, добавляемое в систему в конце титрования, и образующее с веществом рабочего раствора неустойчивое окрашенное соединение;
в) рабочий или исследуемый раствор, исчезновение яркой окраски которого свидетельствует о завершении титрования;
г) индикатор, реакцию с которым проводят вне анализируемой смеси, путём отбора от неё нескольких капель раствора.
65. Точка эквивалентности в редоксиметрии может быть определена:
а) визуально, с помощью кислотно-основных индикаторов;
б) визуально, с помощью редокс-индикаторов;
в) экспериментально, с помощью потенциометрических измерений;
г) визуально, по изменению окраски одного из участников протекающей реакции.
66. Точка эквивалентности в перманганатометрии определяется, как правило:
а) экспериментально, с помощью потенциометрических измерений;
б) визуально, по изменению окраски KMnO4;
в) визуально, с помощью кислотно-основных индикаторов;
г) визуально, с помощью редокс-индикаторов.
67. Точка эквивалентности в иодометрии может быть определена визуально:
а) с помощью редокс-индикаторов;
б) с помощью кислотно-основных индикаторов;
в) с помощью специфических индикаторов;
г) по изменению окраски одного из участников реакции.
68. Для редоксиметрии можно использовать:
а) любые окислительно-восстановительные пары;
б) окислительно-восстановительные пары, не имеющие окраски в водных растворах;
в) окислительно-восстановительные пары, у которых разность их стандартных редокс-потенциалов меньше 0,4 В;
г) окислительно-восстановительные пары, у которых разность их стандартных редокс-потенциалов больше 0,4 В.
69. Интервал перехода для редокс-индикаторов может быть рассчитан по формуле:
а) 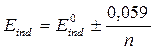 ;
;
б) 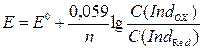 ;
;
в) рН = рКа ± 1;
г) ∆Е = 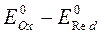 .
.
70. Для создания кислой среды в перманганатометрии используют:
а) любую сильную кислоту;
б) соляную кислоту;
в) разбавленную серную кислоту;
г) разбавленную азотную кислоту.
71. Для определения окислителей в перманганатометрии может быть использован:
а) метод прямого титрования;
б) метод обратного титрования;
в) метод замещения;
г) любой из методов титрования.
72. Рабочими растворами в перманганатометрии являются:
а) раствор KMnO4;
б) раствор KI;
в) раствор Na2S2O3;
г) раствор Н2С2О4.
73. Рабочими растворами в иодометрии являются:
а) раствор Na2C2O4;
б) раствор К2SO4;
в) раствор Na2S2O3;
г) раствор I2 вKI.
74. Стандартными растворами (растворами с приготовленным титром) являются:
а) раствор KMnO4;
б) раствор Na2C2O4;
в) раствор Na2S2O3;
г) раствор KI.
75. Стандартизированными растворами (растворами с установленным титром) являются:
а) раствор I2 вKI;
б) раствор Н2С2О4;
в) раствор Na2S2O3;
г) раствор KMnO4.
Ответы:
Химический эквивалент. Основы титриметрического метода анализа.
| 1. б | 16. в | 31. а; в | 46. а; в | 61. в | ||
| 2. в | 17. г | 32. а; б | 47. в; г | 62. б; в | ||
| 3. а | 18. б | 33. б; в | 48. б | 63. г | ||
| 4. г | 19. а | 34. в | 49. б; в | 64. г | ||
| 5. а; б | 20. б | 35. б; в | 50. а; в | 65. б; в; г | ||
| 6. в | 21. а | 36. а; б; в | 51. б | 66. б | ||
| 7. г | 22. г | 37. а; в | 52. а; в | 67. в; г | ||
| 8. г | 23. в | 38. в | 53. б; г | 68. г | ||
| 9. г | 24. а | 39. а; б; г | 54. а; г | 69. а | ||
| 10. а | 25. г | 40. а; б | 55. б; в | 70. в | ||
| 11. б | 26. в | 41. в; г | 56. а; б | 71. б; в | ||
| 12. б | 27. а | 42. а; б | 57. а; в | 72. а; г | ||
| 13. б | 28. б | 43. а | 58. б | 73. в; г 74. б | ||
| 14.а 15. а | 29. а; б; г | 44. б | 59. в | |||
| 30. б | 45. б; в | 60. б | 75. а; в; г | |||
Учение о растворах
Методические указания
К занятию № 6
Тема: Коллигативные свойства растворов.
Цель: Изучить коллигативные свойства разбавленных растворов неэлектролитов и электролитов, имеющие важное значение для функционирования биологических систем. Освоить криоскопический метод определения молярной массы неэлектролита и изотонического коэффициента электролита.
Исходный уровень:
1. Определение понятий: растворы, электролитическая диссоциация, электролиты, неэлектролиты.
2. Степень диссоциации электролитов.
Вопросы для обсуждения:
1. Коллигативные свойства растворов. Осмос и осмотическое давлениевразбавленных растворах неэлектролитов. Закон Вант-Гоффа.
2. Роль осмотического давления в биологических системах. Гипо-, гипер- и изотонические растворы. Лизис и плазмолиз.
3. Давление насыщенного пара над растворами. Закон Рауля для разбавленных растворов неэлектролитов и следствия из него.
4. Коллигативные свойства разбавленных растворов электролитов. Изотонический коэффициент.
5. Криометрия, эбулиометрия и осмометрия как методы медико-биологических исследований.
Рекомендуемая литература для подготовки:
1. Болтромеюк В.В. Общая химия. Гродно: ГГМУ, 2009. ст. 87-109.
2. Болтромеюк В.В. Физическая и коллоидная химия. Общая химия. Гродно: ГГМУ, 2010. ст. 87-109.
3. Ленский А.С. Введение в бионеорганическую и биофизическую химию, М.,1989. с. 112-125.
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М., Высш. школа, 1975. С.33-45.
