Эквивалент. Закон эквивалентов.
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалентной массой называется масса 1 эквивалента вещества.
Пример 1. Определить эквивалент и эквивалентные массы элементов в соединениях HBr, H2O, NH3.
Решение. В указанных соединениях с 1 молем атомов водорода соединяется 1 моль брома, ½ моля атомов кислорода и 1/3 моля атомов азота. Следовательно, согласно определению, эквиваленты брома, кислорода и азота равны соответственно 1 молю, ½ и 1/3 моля. Исходя из мольных масс атомов этих элементов, находим, что эквивалентная масса брома равна 79,9 г/моль, кислорода – 16*1/2 = 8 г/моль, азота – 14*1/3 = 4,67 г/моль
Пример 2.При соединении 5,6 г железа с серой образовалось 8,8 сульфида железа. Найти эквивалентную массу железа ЭFe и его эквивалент, если известно, что эквивалентная масса серы равна 16 г/моль.
Решение. Из условия задачи следует, что в сульфиде железа на 5,6 г железа приходится 8,8 – 5,6 = 3,2 г серы. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Следовательно:
5,6 г железа эквивалентны 3,2 г серы,
ЭFe г/моль « « 16 г/моль.
Откуда ЭFe = 5,6 * 16/3,2 = 28 г/моль.
Мольная масса атомов железа, численно совпадающая с его относительной молекулярной массой, равна 56 г/моль. Поскольку эквивалентная масса железа (28 г/моль) в два раза меньше мольной массы его атомов, то в 1 моле железа содержится 2 эквивалента. Следовательно, эквивалент железа равен ½ моля.
На основе закона эквивалентов можно вывести следующие формулы для вычисления эквивалентных масс сложных веществ:
Эоксида = 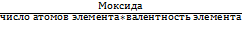
Экислоты = 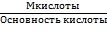
Эоснования= 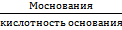
Эсоли = 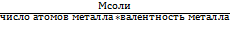
Пример № 3.Определить массу гидросульфата натрия, образующегося при нейтрализации серной кислотой, раствора, содержащего 8 г NaOH.
Решение. Находим эквивалентную массу гидроксида натрия: ЭNaOH = МNaOH/1 = 40 г/моль. Следовательно, 8 г NaOH составляют 8/40 = 0,2 эквивалентной массы NaOH. Согласно закону эквивалентов, масса образовавшейся соли также составляет 0,2 ее эквивалентной массы. Находим эквивалентную массу соли: ЭNaHSO4 = MNaHSO4/1 = 120 г/моль. Масса образовавшегося гидросульфата натрия равна 120*0,2 = 24 г.
При решении некоторых задач, содержащих сведения об объемах газообразных участников реакции, целесообразно пользоваться значением эквивалентного объема.
Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентом вещества. Значение эквивалентного объема вещества, находящегося в газообразном состоянии, можно найти, зная, что в мольном объеме любого газа, состоящего из одноатомных молекул, содержится 1 моль атомов; состоящего из двухатомных молекул – 2 моля атомов и т.д. так, в 22,4 л Н2 содержится при н.у. 2 атома водорода. Поскольку эквивалент водорода равен 1 моль, то в 22,4 л Н2 содержатся 2 эквивалента водорода; значит, эквивалентный объем водорода равен 22,4/2 = 11,2 л/моль.
Пример № 4.Некоторое количество металла, эквивалентная масса которого равна 28 г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла.
Решение. Для решения используем формулу: м1/м2 = э2/э1, отсюда м2 = м1*э1/э2 м2=0,7*28/11,2 = 1,75 г
Задачи для самостоятельного решения
Задача №1.При сгорании 5,00 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла. (Ответ: 9,01 г/моль)
Задача №2.Одно и то же количество металла соединяется с .2 г кислорода и с 3,17 г одного из галогенов. Определить эквивалентную массу галогена. (Ответ: 127 г/моль))
Задача №3.Масса 1 л кислорода равна 1,4 г. сколько литров кислорода расходуется при сгорании 21 г магния, эквивалент которого равен ½ моля? (Ответ: 10 л).
Задача №4.Определить эквивалентные массы металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида. (Ответ: 108 г/моль и 16,0 г/моль).
Задача №5.Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляются 0,680 л кислорода (н.у.). (Ответ: 137,4; Ва)
Задача №6.Мышьяк образует два оксида, из которых один содержит 65,2% As, а другой 75,7% As. Определить эквивалентные массы мышьяка в обоих случаях. (Ответ: 15,0 г/моль; 24,9 г/моль).
Задача №7.Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (н.у.). (Ответ: 56,0 г/моль; 3,36 л).
