Электрофильное присоединение галогеноводородов
Реакция идет легко. При этом образуется смесь продуктов 1,2- и 1,4-присоединения. Их соотношение зависит от природы реагента и условий проведения реакции.
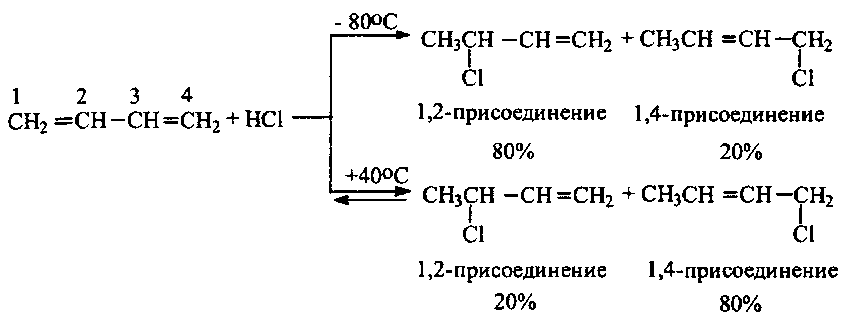
Реакции сопряженных диенов с галогеноводородами идут по механизму электрофильного присоединения (Ae). Полярная молекулаHδ+ →Xδ-своим положительно заряженным концом притягивается π-электронным облаком диена с образованием π-комплекса, который затем медленно перегруппировывается в карбокатион.
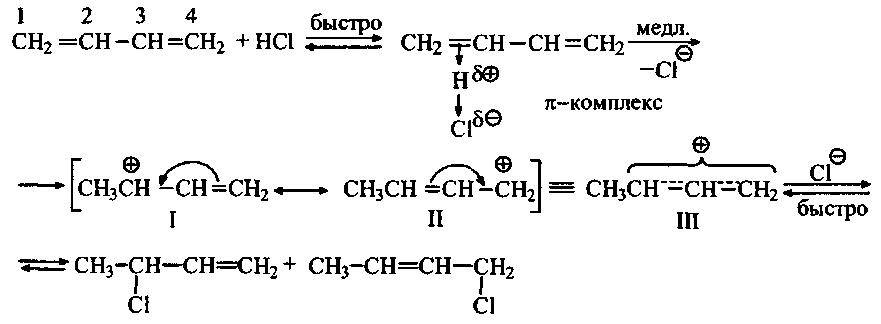
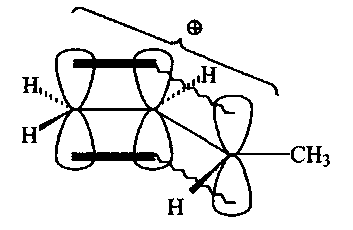
Атомно-орбитальная модель мезомерного карбокатиона аллильного типа
Вследствие сопряжения карбокатионного центра с соседней π-связью положительный заряд распределяется также и на 4-й атом углерода (структура II).
Строение образовавшегося карбокатиона условно изображают двумя предельными структурами I, II. Как уже отмечалось в введении,такие структуры называют резонансными. Ни одна из них не отражает строение реального карбокатиона, которое является промежуточным между двумя граничными состояниями. Это промежуточное состояние карбокатиона отражает формула III - резонансный гибрид. В этой формуле пунктирные линии между атомами показывают, что пара электронов л-связи делокализована в поле трех ядер, а положительный заряд распределен между атомами 2 и 4, что обозначают знаками §+. Карбокатион такого строения называют резонансно-стабилизированным. На последней стадии к электронодефицитным атомам 2 и 4 присоединяется хлорид-анион и образуются два продукта.
Карбокатионы, стабилизированные резонансом, более устойчивы, чем третичные. Этим объясняется более высокая реакционная способность в реакциях присоединения сопряженных диенов по сравнению с алкенами.
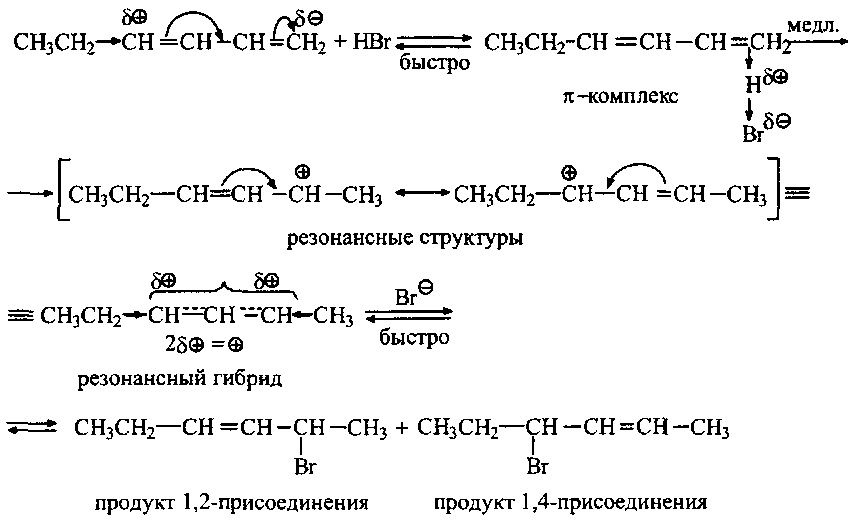
Реакции присоединения галогеноводородов к несимметричным диенам протекают по правилу Марковникова с промежуточным образованием наиболее устойчивого карбокатиона. Направление реакций в таких системах определяется также влиянием заместителя на распределение электронной плотности в цепи сопряжения:
Присоединение галогенов
Реакции присоединения хлора и брома протекают аналогично реакциям с галогеноводородами. Соотношение продуктов 1,2- и 1,4-присоединения также зависит от природы реагентов и условий проведения реакции:
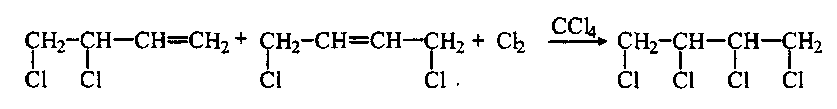
В присутствии избытка реагента к оставшейся двойной связи в продуктах 1,2- и 1,4-присоединения может присоединиться еще одна молекула реагента:
Реакции окисления:
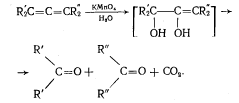
Кумулированные диены легко окисляются водным раствором перманганата калия в нейтральной или слабощелочной среде, а также раствор перманганата калия в уксусной кислоте или пиридине вызывают расщепление до карбонильных соединений.
Реакцию димеризации диенов можно рассматривать как частный случай диенового синтеза – соединение 2-х молекул в одну (димер)
Диеновый синтез, реакция 1,4-присоединения диеновых углеводородов с сопряжёнными двойными связями (диенов) к ненасыщенным соединениям (диенофилам). В результате Диеновый синтез образуются шестичленные циклы, содержащие двойную связь между вторым и третьим атомами углерода исходного диена. Типичный пример Диеновый синтез — получение ангидрида тетрагидрофталевой кислоты (III) из бутадиена-1,3 (I) и малеинового ангидрида (II):
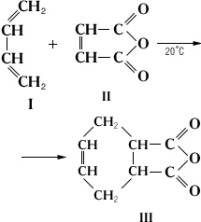
Диенофилами обычно служат соединения, содержащие этиленовую или ацетиленовую связь, активированную электроотрицательной группой (— CO —, — COOR, — CN, — NO2 или др.). С такими диенофилами Диеновый синтезосуществляют простым смешением или нагреванием реагентов при 100—120°С. При отсутствии активирующей группы в диенофиле для Диеновый синтез необходимы жёсткие условия. В качестве диенофилов можно применять также карбонильные соединения, например гексафторацетон (CF3)2C = О, нитрозосоединения, например нитрозобензол C6H5— N = О, азосоединения, например гексафторазометан CF3 — N = N — CF3 и др. Роль диенов могут выполнять гетероциклические соединения, например фуран.
Диеновый синтез широко применяют в синтетической органической химии, в том числе для синтеза стероидов.
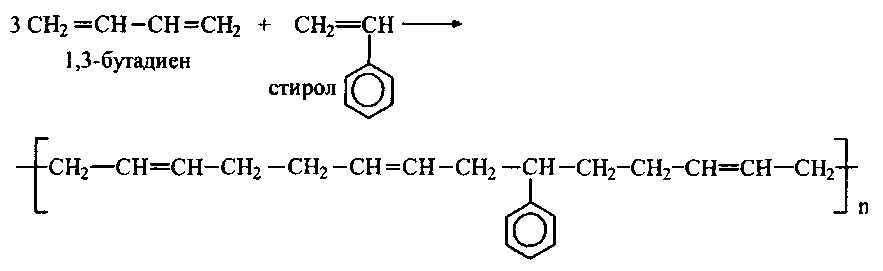
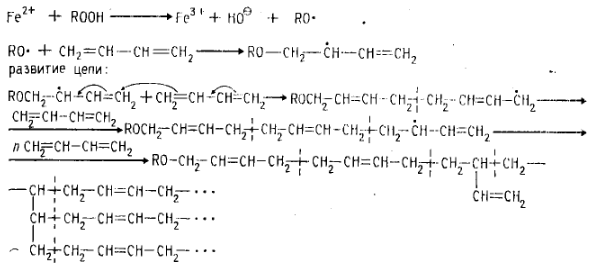
Полимеризация диенов:
Радикальный механизм
7. Ацетиленовые углеводороды (алкины). Номенклатура. Получение. Химические свойства: реакции электрофильного присоединения: галогенирование, гидрогалогенирования, гидролиз (реакция Кучерова); реакции нуклеофильного присоединения: присоединение спиртов, синильной и карбоновых кислот.
Алкинами называются непредельные углеводороды, молекулы которых содержат одну тройную связь. Первый представитель этого класса — ацетилен НС ≡ СН, в связи с чем алкины также называют ацетиленовыми углеводородами. Ближайшие гомологи ацетилена:
| СН3-С ≡ СН | СН3-СН2-C ≡ СН | СН3-С ≡ С-СН3 |
| пропин | бутин-1 | бутин-2 |
Простейший алкин с разветвленным углеродным скелетом:
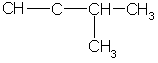
З-метилбутин-1
Общая формула гомологического ряда алкинов СnН2n-2. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами.
Строение. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. Две s-связи, образованные гибридными орбиталями, располагаются по одной линии под углом 180° друг к другу; две p-связи образованы при перекрывании двух пар негибридных 2p-орбиталей соседних атомов углерода. Дополнительное связывание двух атомов углерода приводит к тому, что расстояние между ядрами уменьшается, поскольку тройная связь является сочетанием одной s- и двух p-связей. Длина тройной связи С ≡ С составляет 0,120 нм, что меньше длины как одинарной, так и двойной связи. Энергия тройной связи составляет 828 кДж/моль.
Структурная изомерия алкинов обусловлена изомерией углеродного скелета (например, 3-метилбутин-1 и пентин-1) и изомерией положения тройной связи (бутин-1 и бутин-2). Пространственная изомерия для алкинов не характерна.
Номенклатура. В алкинах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится тройная связь. В названии соответствующего алкана окончание -ан заменяется на -ин. В разветвленных алкинах выбирают главную цепь так, чтобы она содержала тройную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение тройной связи, например:
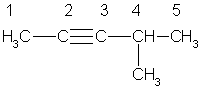 4-метилпентин-2
4-метилпентин-2
Получение.
1. Общий способ получения алкинов — отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под действием спиртового раствора щелочи.
| С2Н5ОН | ||
| СН2Вr - СН2Вr + 2КОН | → | НС ≡ СН + 2КВr + 2Н2О, |
| С2Н5ОН | |||
| СН3 - СВr2 - СН3 + 2КОН | → | СН3-С ≡ СН + 2КВr + 2Н2О, |
2. Гомологи ацетилена можно также получать, действуя галогеналканами на соли ацетиленовых углеводородов (ацетилениды):
CH3 - C ≡ CNa + I-R → CHg - C ≡ C-R + NaI.
Эта реакция представляет собой пример нуклеофильного замещения, а нуклеофилом в ней является ацетиленидный карбанион
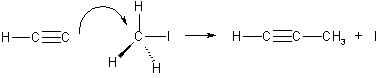
3. Ацетилен получают в промышленности путем высокотемпературного крекинга метана:
| 1500°С | ||
| 2СН4 | → | CH ≡ NCH + ЗН2 |
или его ближайших гомологов — этана и пропана, причем в этом случае ацетилен образуется при более низких температурах:
| 1200°С | 1200°С | ||||
| C2Hg | → | C2Hg + 2Н2, | 2С3Н8 | → | ЗС2Н2 + 5Н2 |
Сырьем в этих способах служит природный газ или нефть.
В лабораторных условиях ацетилен получают гидролизом карбида кальция:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2 ↑
Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакцииэлектрофильного присоединения АE. Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что p-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
| Вr2 | Вr2 | |||
| СН ≡ СН | → | СНВr = СНВr | → | СНВr 2- СНВr2 |
Алкины, так же, как и алкены, обесцвечивают бромную виду.
2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 — сильнуюкислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера поливинилхлорида.
| АlСl3 | ||
| СН ≡ СН + HCI | → | СН2 = СНСl |
В случае избытка галогеноводорода происходит полное гидрогалогенирование, причем для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова, например:
| Аl Вr3 | ||
| СН3 - С ≡ СН + 2НВr | → | СН3 - СВr2 - СН3 . |
3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (II)'
| Hg2+. H+ | ||||||
| CH | ≡ | СН + Н2О | → | [СН2 = СН - ОН] | ≡ | СН3 – СН = О |
На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами.
Отличительной чертой енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом p-связь между атомами углерода разрывается, и образуется p-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С = О по сравнению с двойной связью С = С.
В результате реакции гидратации только ацетилен превращается в альдегид; гидратация гомологов ацетилена протекает по правилу Марковникова;, и образующиеся енолы изомеризуются в кетоны. Так, например, пропин превращается в ацетон:
| Hg2+ | ||
| СН3 – СН ≡ СН + Н2О | → | [СН3 - С(ОН) = СН2] → СН3 – СО - СН3. |
Реакция гидратации алкинов была открыта М.Г. Кучеровым (1881 г.) и носит название реакции Кучерова.
4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т.е. проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией s-связи: ≡ С← Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии.
Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемыеацетиленидами:
R - C ≡ C-H + NaH → R-C ≡ C - Na + Н2
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эти реакции служат для обнаружения алкинов с тройной связью на конце цепи.
| НС ≡ СН + 2[Ag(NH3)2]OH → Ag-C ≡ C-Ag | ↓ | + 2NH3 + Н2O |
| белый осадок |
| R-C ≡ CH + [Cu(NH3)2]Cl → R-C ≡ C- Cu | ↓ | + NH4Cl + NH3. |
| красный осадок |
Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина:
R-C = C-Cu + HCl → R-C = CH + CuCl.
Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, давая винилацетилен:
НС = СН + НОСH → СН2 = СН-ОСН.
Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
СН2 = СН-С = СН + HCl → СН2 = СН – ССl = СН2.
При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:
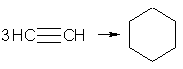
В аналогичные реакции тримеризации могут вступать также и ближайшие гомологи ацетилена, например:
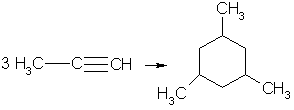
6. Реакции окисления и восстановления. Алкины легко окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи, и образуются карбоновые кислоты:
R - C ≡ C-R' + 3[О] + Н2О → R - COOH + R' - COOH.
В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:
| Н2 | Н2 | |||
| СН3 — С ≡ СН | → | СН3 — СН — СН2 | → | СН3 — СН2 — СН3. |
Присоединение спиртов:
В результате этой реакции образуются простые виниловые эфиры
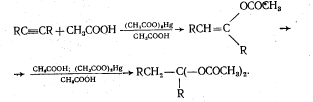
Присоединение карбоновых кислот:
Реакция катализируется солями ртути и протекает по правилу Марковникова.
Присоединение синильной кислоты:
Синильная кислота присоединяется к ацетилену в присутствие солей одновалентной меди с образованием акрилонитрила
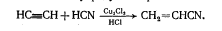
Применение. На основе ацетилена развились многие отрасли промышленности органического синтеза. Выше уже отмечена возможность получения уксусного альдегида из ацетилена и различных кетонов из гомологов ацетилена по реакции Кучерова. в свою очередь, большой интерес представляют реакции алкинов с кетонами. Например, реакцией ацетилена с ацетоном можно получить изопрен — исходный продукт для получения синтетического каучука. Хлоропрен также получают из винилаиетилена. Ацетилен используется для сварки (кислородноацетиленовая сварка) металлов, поскольку при его горении развивается высокая температура.
