Равновесия в буферных растворах
Буферными называют растворы, способные поддерживать определенное значение рН при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи.
Буферное действие основано на связывании добавляемых ионов Н+ или ОН- в молекулы малодиссоциированных соединений.
Различают следующие типы буферных растворов.
1. Смесь слабой кислоты и ее соли, например, СН3СООН + NaCH3COO (уксусная кислота + ацетат натрия). При добавлении сильной кислоты к этому раствору анионы соли связывают ионы Н+ в молекулы малодиссоциированной уксусной кислоты:
| СН3СОО- + Н+ Û СН3СООН | (78) |
При добавлении щелочи протекает реакция нейтрализации:
| СН3СООН + ОН- Û СН3СОО- + Н2О. | (79) |
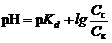 , , | (80) |
где pKd – показатель константы диссоциации слабой кислоты, pKd = –lgKd; Сс и Ск – концентрации соли и килоты соответственно, моль/л
2. Смесь средней и кислой соли или двух кислых солей слабой многоосновной кислоты, например, Na2CO3 + NaHCO3 или Na2HPO4 + NaH2PO4. Анионы кислой соли реагируют подобно слабой кислоте в п.1.
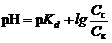 , , | (81) |
где Сс и Ск – концентрации кислой и средней соли соответственно, моль/л
3. Кислые соли слабых многоосновных кислот, при добавлении к растворам которых сильных кислот или щелочей протекают аналогичные реакции:
| НСО3- + Н+ Û Н2СО3; | (82) |
| НСО3- + ОН- Û СО32- + Н2О | (83) |
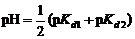 , , | (84) |
где pKn – показатель контснты диссоциации кислоты по соответствующей ступени.
4. Смесь слабого основания и его соли, например, NH4OH + NH4Cl. Буферное действие основано на реакциях:
| NH4OH + H+ Û NH4+ + H2O; | (85) |
| NH4+ + OH- Û NH4OH. | (86) |
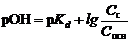 , , | (87) |
где pKd – показатель константы диссоциации слабого основания; Сс и Сосн – концентрации соли и основания соответственно, моль/л
5. Соли слабых кислот и слабых оснований, например, NH4CH3COO. Буферное действие обусловлено реакциями:
| NH4+ + OH- Û NH4OH; | (88) |
| CH3COO- + H+ Û CH3COOH. | (89) |
Емкостью буферного раствора Вназывают количество сильной кислоты или щелочи, которое требуется добавить к 1 л раствора для изменения его рН на единицу. Раствор утрачивает буферные свойства при добавлении сильной кислоты или щелочи в количестве, превышающем буферную емкость. Различают буферную емкость раствора по кислоте и по щелочи.
Емкость кислого буфера по щелочи, ВЩ.
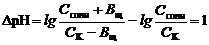 . . | (90) |
При решении уравнения получаем:
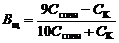 . . | (91) |
емкости кислого буфера по кислоте:
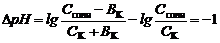 . . | (92) |
Отсюда получаем формулу для расчета
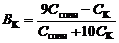 . . | (93) |
Емкости основного буфера по кислоте и по щелочи:
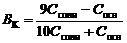 . . | (94) |
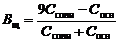 . . | (95) |
Выбор состава буферного раствора. Отношение Сс/Ск или Сс/Сосн выбирают в пределах 0,1<Ссоли/Ск-ты <10. По таблицам констант диссоциации подбирают слабую кислоту с pKd=pH±1(или слабое основание с pKd = pOH ±1), исходя из заданного рНвычисляют отношение концентраций Сс/Ск (или Сс/Сосн).
Примеры решения задач
Пример 1. Вычислить изменение рН ацетатного буферного раствора, содержащего по 1 моль/л кислоты и соли после добавления к 1 л раствора 0,1 моль соляной кислоты.
Решение. 1. вычислим рН данного буферного раствора по формуле (112)
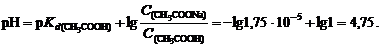
2. После добавления к буферному раствору соляной кислоты концентрация ацетата натрия уменьшится, концентрация уксусной кислоты увеличится вследствие протекания реакции:
CH3COONa + HCl ® CH3COOH + NaCl на величину 0,1 моль/л.
3. Вычислим рН нового раствора:
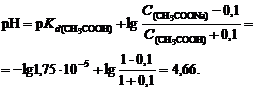
4. Найдем изменение рН: ΔрН = 4,75 - 4,66 = 0,09.
Пример 2. К 0,8 л 0,5 М раствора НСООН (Kd = 1,8×10-4) добавили 0,2 л 0,4 М раствора NaOH. Вычислить рН образовавшегося формиатного буфера и его буферную емкость по кислоте и щелочи.
Решение. 1. Вычислим количество вещества НСООН и NaOH:
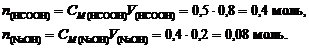
2. Объем буферного раствора V равен:
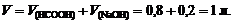
3. Определим количество вещества формиата натрия, образующегося по реакции NaOH+HCOOH®HCOONa+H2O:
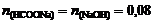 моль.
моль.
Найдем молярную концентрацию формиата натрия в буферном растворе:
 моль/л.
моль/л.
4. Найдем остаточное количество вещества муравьиной кислоты:
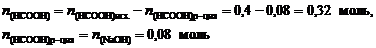
и ее молярную концентрацию в буферном растворе
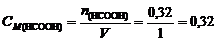 моль/л.
моль/л.
5. Определим рН буферного раствора
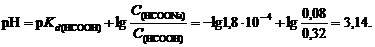
6. Буферную емкость по кислоте определим при помощи уравнения (120):
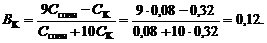
Буферную емкость по щелочи определим при помощи уравнения (119):
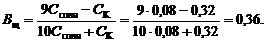
Пример 3. Сколько граммов твердого формиата натрия HCOONa надо добавить к 100 мл 0,2 М раствора соляной кислоты, чтобы получить буферный раствор с рН = 4,3?
Решение. 1. При добавлении к раствору соляной кислоты формиата натрия образуется муравьиная кислота по реакции: HCOONa + HCl ® HCOOH + NaCl,
С(HCOOH) = С(HCl) = 0,2 моль/л.
2. Для образования формиатного буферного раствора необходима определенная концентрация формиата натрия, которую найдем исходя из формулы (114):
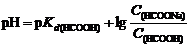
откуда 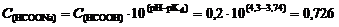 моль/л.
моль/л.
3. Определим количество вещества формиата натрия, необходимого для получения данного буферного раствора: 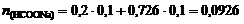 моль и его массу
моль и его массу 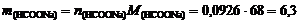 г.
г.
Задачи для решения
390. К 200 мл 0,5 н. раствора уксусной кислоты добавили 10 мл 0,8 н. раствора едкого натра. Определить рН полученного раствора.
391. Какой объем 20 % раствора уксусной кислоты плотностью 1,026 г/см3 следует прилить к 1 л 0,075 н. раствора ацетата натрия, чтобы получить буферный раствор с рН = 2,75?
392. Рассчитать рН раствора, содержащего 1,5 моль/л ацетата натрия и 0,75 моль/л уксусной кислоты. На сколько изменится величина рН в результате добавления к 50 мл этого раствора 1 мл 2 н. раствора едкого натра?
393. Сколько граммов безводного бензойнокислого натрия необходимо прибавить к 100 мл 0,02 моль/л раствора бензойной кислоты С6Н5СООН, чтобы получить буферный раствор с рН=5?
394. К 25 мл 2 % раствора гидроксида аммония плотностью 0,99 г/см3 добавили 1,5 г хлорида аммония. Определить рН полученного раствора, если его плотность равна 1,01 г/см3.
395. Как изменится рН в 0,1 н. растворе уксусной кислоты после добавления к нему кристаллического ацетата натрия до концентрации 0,1 моль/л?
396. На сколько изменится рН раствора, полученного смешиванием 100 мл 5 % раствора муравьиной кислоты плотностью 1,008 г/см3 и 100 мл 7 % раствора формиата калия плотностью 1,01 г/см3, если к нему прилить 50 мл 0,2 н. раствора едкого калия?
397. Какой объём 20 % фосфорной кислоты (плотность 1,113 г/мл) надо добавить к 2 л раствора едкого калия с концентрацией 0,2 моль/л для получения буферного раствора с рН=6?
398. На сколько изменится рН раствора, содержащего в 200 мл 2,14 г хлорида аммония и 2,1 г гидроксида аммония, в результате добавления к нему 10 мл 2 н. раствора соляной кислоты?
399. Какой объем 0,5 моль/л раствора гидроксида бария следует добавить к 1,5 л 5 % раствора уксусной кислоты (плотность 1,006 г/см3), чтобы получить буферный раствор с рН=4?
400. Рассчитать рН раствора, полученного смешиванием 10 м3 2 % раствора едкого натра (плотность 1,021 г/см3) и 15 м3 5 % фосфорной кислоты (плотность 1,026 г/см3).
401. Какой объем 20 %-ной серной кислоты (плотность 1,139 г/мл) необходимо добавить к 5 л раствора этиламина с концентрацией 0,02 моль/л для получения буферного раствора с рН=9,8?
402. К 5 л 5 % раствора гидроксида аммония плотностью 0,986 г/мл добавили 10 л 3 % раствора серной кислоты плотностью 1,019 г/мл. Определить рН полученного раствора.
403. Определить рН, борно-натриевого буферного раствора, если концентрация Н3ВО3 15 %, NaH2BO3 10 %, а средняя плотность раствора 1,12 г/см3.
404. Рассчитать рН раствора, полученного путем поглощения 20 л углекислого газа раствором едкого натра в количестве 6 л и с концентрацией 0,1 моль/л. Процесс вели при температуре 25°С и давлении 1 атм.
405. Определить рН, фосфорно-натриевого буфера, если в 1 л раствора содержится 19,6 г фосфорной кислоты и 30 г дигидрофосфата натрия.
406. Объем хлористого водорода, равный 5 м3, был измерен при температуре 100°С и давлении 1,5 атм. Определить рН раствора, полученного в результате поглощения этого газа 5 м3 раствора гидроксида аммония с концентрацией 0,1 моль/л.
407. Рассчитать рН раствора, в 1 л которого содержится 12,5 г ацетата натрия и 17,5 г уксусной кислоты.
408. Какой объем аммиака должен быть поглощен при 25°С и давлении 1 атм 2 % раствором серной кислоты плотностью 1,012 г/мл в количестве 300 мл, чтобы полученный раствор имел значение рН=10?
409. Каков рН аммиачно-хлоридного буфера, содержащего в 1 л 70 г гидроксида аммония и 26,7 г хлорида аммония?
410. Какой объем 4,27 % раствора аммиака плотностью 0,98 г/см3 надо добавить к 200 мл 0,1 н. раствора соляной кислоты, чтобы получить буферный раствор с рН=8,24?
411. Рассчитать рН смеси карбоната и гидрокарбоната калия с концентрацией по 0,02 моль/л.
412. Сколько миллилитров 6 % раствора уксусной кислоты плотностью 1,007 г/см3 следует прилить к 100 мл 0,6 % раствора едкого натра плотностью 1,005 г/см3, чтобы получить буферный раствор с рН=4,18?
413. Рассчитать рН раствора дигидрофосфата натрия с концентрацией 1 моль/л
414. Сколько граммов гипобромита натрия NaBrO следует добавить к 10 л 0,5 н. раствора бромноватистой кислоты, константа диссоциации которой равна 2,06×10-9, чтобы получить буферный раствор с рН=6,74?
415. Рассчитать рН раствора гидросульфида калия с концентрацией 1 моль/л.
416. Какой объем аммиака должен быть поглощен при 25°С и давлении 1 атм 2 % раствором соляной кислоты (плотность 1,008 г/см3) в количестве 300 мл, чтобы полученный раствор имел значение рН=10?
417. Каково значение рН аммиачно-хлоридного буфера, содержащего в 1 л 70 г гидроксида аммония и 26,7 г хлорида аммония?
418. Как изменится рН СН3СООН в 0,2 М растворе, если к 100 мл этого раствора прибавили 30 мл 0,3 М раствора ацетата натрия.
419. Рассчитать рН полученного раствора, если к 100 мл 0,0375 М СН3СООН прибавили 0,102 г CH3COONa.
420. Вычислить рН раствора, полученного смешиванием 25 мл 0,2 М СН3СООН и 15 мл 0,1 М CH3COONa.
421. Вычислить рН полученного раствора, если в 1 л воды содержится 60,05 г СН3СООН и 82,03 г CH3COONa.
422. Вычислить рН раствора, если к 2 л воды прибавили 23 г НСООН и 21 г НСООК.
423. Вычислить рН раствора, полученного смешиванием 15 мл 0,1 м НСООН и 12 мл 0,2 М HCOONa.
424. Какой объем 0,2 М NaOH надо прибавить к 40 мл 0,1 М раствора лимонной кислоты, чтобы получить раствор с рН = 3,0?
425. Какой объем раствора NaOH концентрацией 0,4 % надо прибавить к 23 мл 0,2 М раствора ортофосфорной кислоты, чтобы получить раствора с рН = 2,3?
426. Какую массу гидроксида натрия надо растворить в 100 мл 0,1 М раствора гидрокарбоната натрия, чтобы получить раствор с рН = 10?
427. Какую массу гидрокарбоната натрия надо растворить в 30 мл раствора гидроксида натрия концентрацией 1 %, чтобы получить раствор с рН = 10,0?
428. Как изменится рН 1 % раствора НСООН, если к 230 мл этого раствора прибавить 540 мл раствора НСООK концентрацией 0,5 %?
429. Сколько миллилитров 0,2 м HCl надо добавить к 50 мл 0,1 М Na2CO3, чтобы получить раствор с рН=10,5?
