Электролитическая ионизация воды. Водородный показатель pH. Индикаторы. Понятие о буферных растворах.
Вода хотя и весьма незначительно, но все же диссоциирует на ионы: 
 Вода является самым типичным амфотерным электролитом, т.е. она может действовать в равной степени и как кислота, и как основание. Установлено, что константа ионизации воды равна:
Вода является самым типичным амфотерным электролитом, т.е. она может действовать в равной степени и как кислота, и как основание. Установлено, что константа ионизации воды равна: 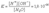 Судя по этому значению, вода является очень слабым электролитом.По величине электропроводности чистой воды можно вычислить концентрацию ионов водорода и гидроксид – ионов в воде.При 25˚С она равна 1,0·10-7 моль/л.Перепишем константу диссоциации воды.
Судя по этому значению, вода является очень слабым электролитом.По величине электропроводности чистой воды можно вычислить концентрацию ионов водорода и гидроксид – ионов в воде.При 25˚С она равна 1,0·10-7 моль/л.Перепишем константу диссоциации воды.  Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул Н2О в воде практически равна общей концентрации воды, т.е.
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул Н2О в воде практически равна общей концентрации воды, т.е.  (1л содержит 1000 г воды, т.е.
(1л содержит 1000 г воды, т.е.  ). Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной t˚ произведение концентрации ионов водорода и гидроксид – ионов есть величина постоянная. Она называется ионным произведением воды.Эти растворы, в которых концентрация ионов водорода и гидроксид – ионов одинаковы, называются нейтральными растворами. В кислых растворах больше концентрация ионов водорода, в щелочных – гидроксид – ионов. Но какой бы ни была реакция раствора, произведение
). Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной t˚ произведение концентрации ионов водорода и гидроксид – ионов есть величина постоянная. Она называется ионным произведением воды.Эти растворы, в которых концентрация ионов водорода и гидроксид – ионов одинаковы, называются нейтральными растворами. В кислых растворах больше концентрация ионов водорода, в щелочных – гидроксид – ионов. Но какой бы ни была реакция раствора, произведение  остается постоянным. Это значит, что если концентрация ионов водорода известна, то можно вычислить концентрацию ионов гидроксида. Для оценки кислотности и щелочности среды удобно пользоваться не концентрацией водородных ионов, а водородным показателем рН. Он равен десятичному логарифму концентрации водородных ионов, взятому с обратным знаком.
остается постоянным. Это значит, что если концентрация ионов водорода известна, то можно вычислить концентрацию ионов гидроксида. Для оценки кислотности и щелочности среды удобно пользоваться не концентрацией водородных ионов, а водородным показателем рН. Он равен десятичному логарифму концентрации водородных ионов, взятому с обратным знаком.  Например, если
Например, если  то
то  .Чем выше концентрация водородных ионов, тем меньше рН. Водородный показатель может быть больше 14 и может принимать отрицательные значения (в очень кислой среде). В любом водном растворе
.Чем выше концентрация водородных ионов, тем меньше рН. Водородный показатель может быть больше 14 и может принимать отрицательные значения (в очень кислой среде). В любом водном растворе  .Водородный показатель измеряется различными методами. Сравнительно грубое, но быстрое определение рН можно произвести с помощью специальных реактивов – индикаторов, окраска которых меняется в зависимости от концентрации водородных ионов (кислая/нейтральная/щелочная): лакмус (красный/фиолетовый/синий), метилоранж (розовый/оранжевый/желтый) и фенолфталеин ( - / - / малиновый) Точное значение рН можно определить, измерив э.д.с. гальванического элемента, имеющего электрод, потенциал которого зависит от концентрации ионов водорода.Обычно используют стеклянный электрод. На практике рН измеряют потенциометрами или рН – метрами (0–14). Буферные растворыОчень разбавленные растворы кислот или щелочей с постоянным значением рН нельзя получить путем разбавления сильных кислот или оснований, т.к. незначительное количествоСО2 из воздуха, щелочей из стекла посуды или загрязнений в дистиллированной воде могут заметно изменить реакцию таких растворов. Однако, в лаборатории часто требуется иметь раствор с вполне определенным и постоянным значением рН. Такие растворы готовят смешиванием слабых кислот или слабых оснований с их солями.Рассмотрим раствор, содержащий СН3СООН и СН3СООNa. Из уравнения константы ионизации уксусной кислоты следует:
.Водородный показатель измеряется различными методами. Сравнительно грубое, но быстрое определение рН можно произвести с помощью специальных реактивов – индикаторов, окраска которых меняется в зависимости от концентрации водородных ионов (кислая/нейтральная/щелочная): лакмус (красный/фиолетовый/синий), метилоранж (розовый/оранжевый/желтый) и фенолфталеин ( - / - / малиновый) Точное значение рН можно определить, измерив э.д.с. гальванического элемента, имеющего электрод, потенциал которого зависит от концентрации ионов водорода.Обычно используют стеклянный электрод. На практике рН измеряют потенциометрами или рН – метрами (0–14). Буферные растворыОчень разбавленные растворы кислот или щелочей с постоянным значением рН нельзя получить путем разбавления сильных кислот или оснований, т.к. незначительное количествоСО2 из воздуха, щелочей из стекла посуды или загрязнений в дистиллированной воде могут заметно изменить реакцию таких растворов. Однако, в лаборатории часто требуется иметь раствор с вполне определенным и постоянным значением рН. Такие растворы готовят смешиванием слабых кислот или слабых оснований с их солями.Рассмотрим раствор, содержащий СН3СООН и СН3СООNa. Из уравнения константы ионизации уксусной кислоты следует:  При введении в раствор хорошо диссоциирующего CH3COONa диссоциация кислоты подавляется. В результате этого концентрация недиссоциированных молекул СН3СООНстановится почти равной общей концентрации кислоты, а концентрация СН3СОО равна общей концентрации соли. Тогда предыдущее уравнение можно записать:
При введении в раствор хорошо диссоциирующего CH3COONa диссоциация кислоты подавляется. В результате этого концентрация недиссоциированных молекул СН3СООНстановится почти равной общей концентрации кислоты, а концентрация СН3СОО равна общей концентрации соли. Тогда предыдущее уравнение можно записать: 
 Так как К – постоянная величина, то концентрация водородных ионов в таком растворе будет определяться отношением концентрации кислоты к концентрации соли. Разбавление этого раствора практически не изменит его рН.Даже добавление некоторого количества сильной кислоты не повлияет заметно на рН такого раствора, т.к. введенные ионы Н+ свяжутся с анионом в недиссоциирующие молекулы слабой кислоты. Почти не изменится рН и при добавлении щелочи.Растворы слабой кислоты и её соли (или слабого основания и его соли), концентрация водородных ионов в которых почти не меняется при введении в них сильной кислоты или сильного основания, называются буферными растворами. Они играют большую роль в регулировании жизненных процессов в организмах животных и растений, широко применяется в лабораторной практике. Примерами буферных систем могут служить аммиачные растворы (NH4OH+NH4Cl) и ацетатные растворы (СН3СООН+СH3COONa) и др. + смеси солей разной кислотности:NaH2PO4+Na2HPO4 (5,3–8) NaHCO3+Na2CO3 и т.п. В этом случае кислый анион заменяет слабую кислоту.
Так как К – постоянная величина, то концентрация водородных ионов в таком растворе будет определяться отношением концентрации кислоты к концентрации соли. Разбавление этого раствора практически не изменит его рН.Даже добавление некоторого количества сильной кислоты не повлияет заметно на рН такого раствора, т.к. введенные ионы Н+ свяжутся с анионом в недиссоциирующие молекулы слабой кислоты. Почти не изменится рН и при добавлении щелочи.Растворы слабой кислоты и её соли (или слабого основания и его соли), концентрация водородных ионов в которых почти не меняется при введении в них сильной кислоты или сильного основания, называются буферными растворами. Они играют большую роль в регулировании жизненных процессов в организмах животных и растений, широко применяется в лабораторной практике. Примерами буферных систем могут служить аммиачные растворы (NH4OH+NH4Cl) и ацетатные растворы (СН3СООН+СH3COONa) и др. + смеси солей разной кислотности:NaH2PO4+Na2HPO4 (5,3–8) NaHCO3+Na2CO3 и т.п. В этом случае кислый анион заменяет слабую кислоту.
26. Комплексообразование в растворах. Структура комплексного соединения. Классификация комплексных соединений.
Комплексные (координационные) соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому) (комплексообразователю), нейтральных молекул или других ионов (лиганды). Комплексные соединения мало диссоциируют в растворе. Комплексные соединения могут содержать анион ([Fe(CN)6]3−), катион ([Ag(NH3)2]+), либо вообще не диссоциировать на ионы (например карбонилы металлов).Структура: В комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определённое число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешную координационную сферу. Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы (например [Pt(NH3)2Cl2]).Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы.Наиболее типичными комплексообразователями являются катионы d-элементов. Лигандами могут быть: а) полярные молекулы — NH3, Н2О, CO, NO; б) простые ионы — F−, Cl−, Br−, I−, H+;в) сложные ионы — CN−, SCN−, NO2−, OH−.
Классификация:По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.). ( [(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II); [Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II) )
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы. ( K2[BeF4] — тетрафторобериллат(II) калия; Li[AlH4] — тетрагидридоалюминат(III) лития; K3[Fe(CN)6] — гексацианоферрат(III) калия )
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул. ( [Ni(CO)4] — тетракарбонилникель; [Pt(NH3)2Cl2] — дихлородиамминплатина(II) )
