Равновесия и расчёт рН в растворах кислот, в растворах оснований, в растворах амфолитов
Кислотно-основные реакции. Типы протолитов по Бренстеду–Лоури. Константы кислотности и основности сопряжённой кислотно-основной пары, их использование для прогнозирования возможности проведения кислотно-основного титрования.
Протолитическая теория кислот и оснований была предложена в 1923 году независимо друг от друга датским учёным Й. Брёнстедом и английским учёным Т. Лоури. В ней понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии: А В + Н. Согласно этой теории кислотами являются молекулы или ионы, способные быть в данной реакции донорами протонов, а основаниями являются молекулы или ионы, присоединяющие протоны. Кислоты и основания получили общее название протолитов.
Сущностью кислотно-основного взаимодействия является передача протона от кислоты к основанию. При этом кислота, передав протон основанию, сама становится основанием, так как может снова присоединять протон, а основание, образуя протонированную частицу, становится кислотой. Таким образом, в любом кислотно-основном взаимодействии участвуют две пары кислот и оснований, названные Бренстедом сопряженными: А1 + В2 А2 + В1.Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием. Например, вода при взаимодействии с сильными кислотами является основанием: H2O + H H3О, а реагируя с аммиаком, становится кислотой: NH3 + H2O NH4 + OH. Главную роль в определении понятий "кислота" и "основание" играет простейшая химическая частица H+ – катион водорода (протон).-Кислота – это водородсодержащая частица вещества (молекула или ион), способная отдавать протон, быть донором протона.HClO4 ↔ H+ + ClO4–;H2O↔ H+ + OH–;NH4+ ↔ H+ + NH3;H3PO4– ↔ H+ + HPO42–;[Al(H2O)6]3+ ↔ H+ + [Al(H2O)5OH]2+.
-Основание – это частица, способная принимать протон (быть акцептором протона).NH3 + H+ ↔ NH4+;OH– + H+ ↔ H2O;HPO42– + H+ ↔ H2PO4–;[Al(H2O)5OH]2+ + H+ ↔ [Al(H2O)6]3+.-Кислоты и основания объединяют под названием протолиты.-Соединения, которые могут быть и кислотами, и основаниями, называют амфолитами. Они способны как отдавать, так и принимать протоны.-Согласно протолитической теории реакция нейтрализации рассматривается как переход протона Н+ от кислоты к основанию.HCI + NH3 GCI- + NH4+кислота1 основание2 основание1 кислота2 -Химическая реакция между протолитами носит название протолитической реакции.HA + B G A- + BH+кислота1 основание2 основание1 кислота2-В любой протолитической реакции всегда есть две сопряженные пары"кислота"/"основание":HA/A– и HB+/ В-Кислота1 HAпереходит в сопряженноеоснование1A–.-Основание2B переходит в сопряженнуюкислоту2HB+.-В реакции между сопряженными парами направление переноса протона Н+ определяется величиной сродства к протону Н+ – энтальпией реакции присоединения протона.-Протолитическое равновесие всегда смещено в сторону более слабого протолита!Сила кислот и оснований оценивается по реакции с водой. Протолитическая реакция вида:В отличие от теории электролитической диссоциации, протолитическая теория показала, что продукты взаимодействия кислот и оснований следует рассматривать как новые кислоты и основания.
Равновесия и расчёт рН в растворах кислот, в растворах оснований, в растворах амфолитов
В водных растворах масса воды в большинстве случаев очень велика по сравнению с массой растворенного вещества, количество ее в 1 л раствора можно считать постоянным. Тогда выражение для константы равновесия запишется следующим образом:К [Н2О] = [Н+] [ОН-] (1.5)Из уравнения (1.5) следует, что ионное произведение является величиной постоянной при постоянной температуре. Эту константу называют ионным произведением воды, которое при температуре 25° С равно
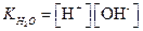 | (1.6) |
В чистой воде [H+] = [OH-] = 1×10-7 M . При избытке [OH-]
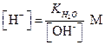 | (1.7) |
При избытке [Н+]
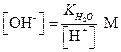 | (1.8) |
Концентрацию водородных ионов обычно используют для характеристики среды. В большинстве расчетов, относящихся к кислотно-основному равновесию, концентрации (и другие величины) удобно выражать в виде отрицательных логарифмов этих величин, обозначаемых знаком "р". Тогда
| -lg[H+] = pH | (1.9) |
| -lg[OH-] = pOH | (1.10) |
Ионное произведение воды тоже можно выразить в логарифмическом виде
рН + рОН = 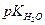 = 14 = 14 | (1.11) |
Для вычисления рН растворов кислот и оснований следует предварительно вычислить молярную концентрацию свободных ионов водорода ( ) или свободных гидроксил ионов ( ), а затем воспользоваться
формулами:
pH=-lg[ H+ ]; рОН-=-lg[ OH-]; рН + рОН =14
Концентрация любого иона в моль/л в растворе электролита можно вычислить по уравнению
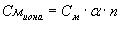 где См иона – молярная концентрация иона в моль/л;
где См иона – молярная концентрация иона в моль/л;
См – молярная концентрация электролита в моль/л;
α-степень диссоциации электролита;
n -количество ионов данного вида, которое получается при распаде одной молекулы электролита.
