Химические свойства галогенпроизводных.
Галогенопроизводные алканов (галогеналканы) имеют очень важное значение для синтеза многих соединений. Замена атомов водорода на галоген делает соединение более химически активным, т.к. связь углерода с более электроотрицательным атомом галогена является полярной, что усиливает реакционную способность в реакциях ионного типа. Полярность ковалентной связи углерод-галоген, например, С–Cl, приводит к смещению электронной плотности к галогену (индуктивный эффект). В ряду F, Cl, Br, I реакционная способность связи растет, т.к. увеличивается длина связи.
1. Синтез алканов с удлинением цепи (реакция взаимодействия с активными металлами (реакция Вюрца)):
2C2H5Cl + 2Na → C4H10 + 2NaCl
Если использовать разные галогенопроизводные, то получается смесь продуктов. Например:
C2H5Cl + 2Na + CH3Cl→ C3H8 + 2NaCl. Но кроме пропана C3H8 образуются бутан C4H10 (из 2-х молекул C2H5Cl) и этан C2H6 (из 2-х молекул CH3Cl).
2. Восстановление: C2H5Cl + HCl → C2H6 + Cl2
3. Получение металлорганическихсоединений: 2C2H5Cl + 2Zn → Zn(C2H5)2 + ZnCl2
4. Отщепление галогеноводородов при действии концентрированных растворов едких щелочей с получением алкенов: C2H5Cl → C2H4 + HCl
Особую группу реакций, составляют реакции замещения галогена на другие группы атомов при действии воды, оснований и солей. Эти реакции протекают по механизму нуклеофильного замещения (SN), т.к. положительно заряженный углеродный атом, связанный с галогеном, является центром атаки нуклеофильными частицами (OH-, OR-, CN-, NH2-, NO2- и др.). Под их действием происходит гетеролитический разрыв полярной связи углерод-галоген. Электронная пара этой связи отходит к более электроотрицательному атому галогена, который превращается в анион:
1. Гидролиз: C2H5Cl + H+(OH)- → C2H5OH + HCl (спирты)
2. Аммонолиз: C2H5Cl + NH3 → C2H5NH2 + HCl (амины)
3. Нитрированиенитратом серебра: C2H5Cl + Ag-NO2 → C2H5NH2+ AgCl (нитросоединения)
4. Действие цианидов: C2H5Cl + Na-CN → C2H5CN + NaCl (нитрилы)
26. Механизмы реакций нуклеофильного замещения(галогенпроизводных?)SN1 SN2.
начинаем с концовки вопроса 24.
Общая схема реакции: R–X + :Y 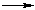 R–Y + :X –,
R–Y + :X –,
где X – галоген; :Y – нуклеофильный реагент – донор пары электронов (OH-, OR-, CN-, NH2-, NO2- и др.).
Замещение галогена может происходить по двух возможным механизмам. Рассмотрим их на примере замещения галогена на гидроксильную группу в пропилхлориде CH3-CHCl-CH3 под действием водного раствора щелочи:
1. Двустадийныймеханизм (SN1):
Cтадия 1. Алкилгалогенид, отщепляя галоген, превращается в карбокатион (медленно идущая реакция): CH3-CHCl-CH3 → CH3-CH+-CH3 + Cl-
Cтадия 2. Карбокатион взаимодействует с нуклеофилом (донором) с образованием конечного продукта (эта реакция идет быстро, и сразу как завершится первая стадия):
CH3-CH+-CH3 + H+-OH- → CH3-CHOH-CH3 + H+
H+ + Cl- → HCl
Первая стадия является лимитирующей, и поскольку в ней участвует одна частица (молекула галогеналкана), называется мономолекулярной (SN1 - механизм мономолекулярного нуклеофильного замещения).
2. Одностадийныймеханизм (SN2):
Заключается в практически одновременном отщеплении галогенид-иона и присоединении аниона (без образования карбокатиона) и идет в одну стадию:
CH3-CH-Cl-CH3 → [CH3-CH(--OH--Cl)-CH3 ] (активированный комплекс) → CH3-CHOH-CH3 + Cl-
Этот механизм называют бимолекулярным нуклеофильным замещением и обозначают SN2.
Механизм протекания замещения зависит от строения реагентов и условий реакции. Для первичных (в зависимости от того, у какого атома углерода (первичного, вторичного или третичного) находится галоген) галогеналканов обычен двухстадийный механизм, а для третичных - одностадийный. У вторичных алкилгалогенидов механизм реакции зависит от условий ее проведения.
Это объясняется следующими факторами:
1. Чем стабильнее карбокатион, тем легче он образуется. Третичный катион R3C+ стабильнее, чем вторичный R2CН+ или первичный RCН2+ (три +I-эффекта алкильных групп R в третичном катионе, два - во вторичном и один - в первичном).
2. И наоборот, энергия переходного состояния тем ниже, чем меньше пространственные препятствия для его достижения, т.е. чем меньше алкильных групп у атакуемого атома углерода. Соответственно, первичная переходная группа более стабильна.
