Реакции элиминирования предельных галогенпроизводных. Механизмы Е1 и Е2. Химические свойства полигалогенпроизводных. Применеие галогенпроизводных. Отдельные представители
Реакция элиминирования (отщепление)
Элиминирование может классифицироваться как α-, β- и γ - элиминирование.
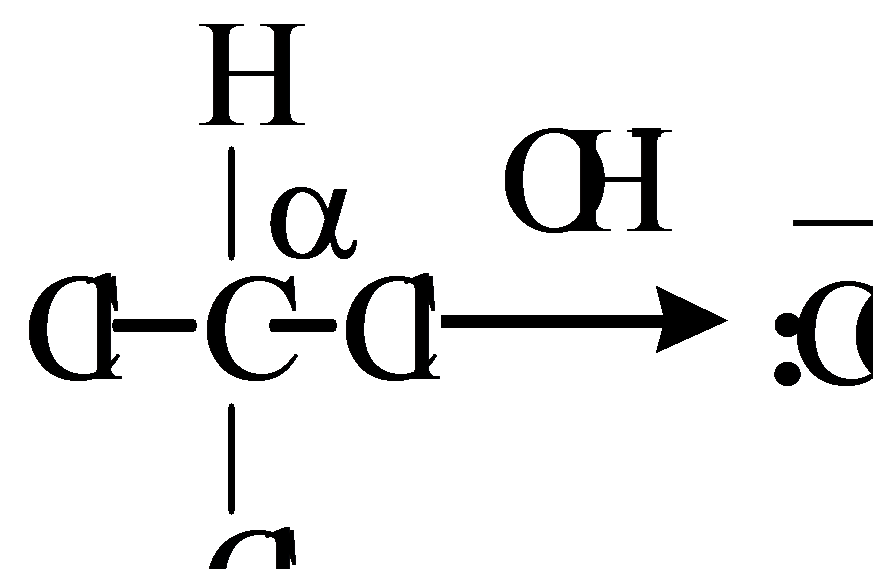
Наиболее часто встречающимся типом реакций отщепления является β-элиминирование. α-Элиминирование может протекать по механизму Е2 и Е1.
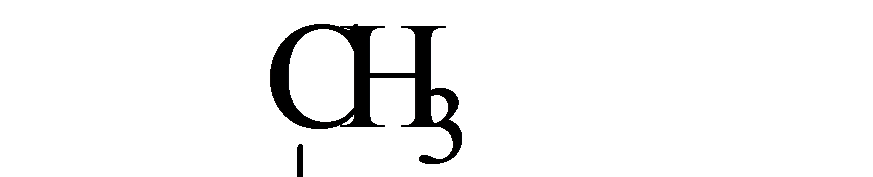
 Реакции Е2
Реакции Е2
Реакции Е2 протекают при действии на галогеналканы сильных оснований (спиртовой раствор КОН):
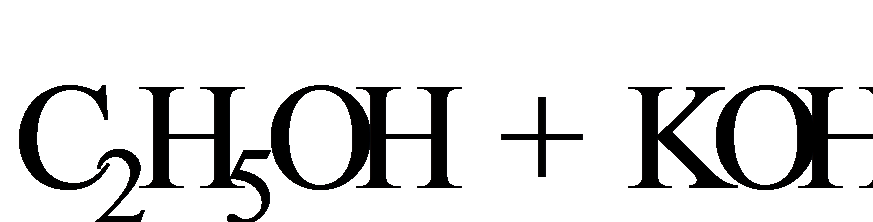
Реакции Е2 часто конкурируют с SN2.
Кинетика реакций отщепления Е2 описывается уравнением второго порядка: v = k [(CH3)2CHBr][C2H5O-]
Энергетическая диаграмма реакции Е2
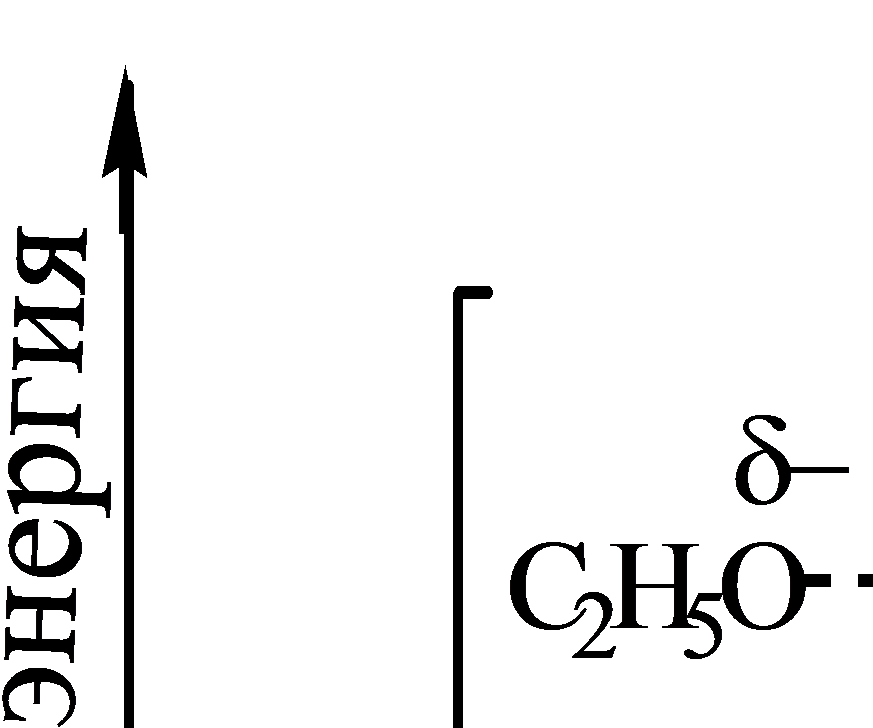
Реакция Е2 представляет собой одностадийный согласованный процесс β-элиминирования, протекающий через переходное состояние, в котором разрыв связей Сα-Х и Сβ-Н и образование π-связи происходят одновременно.
Реакция Е2 подчиняется правилу Зайцева: протон отщепляется преимущественно от наименее гидрогенизированного Сβ-атома:

Реакции Е1
Реакции Е1 часто конкурируют с SN1 и подчиняются тем же закономерностям.
Механизм элиминирования Е1 включает 2 стадии: отщепление галогена с образованием карбкатиона и отщепление протона от атома углерода (Сβ), соседнего с катионным центром (Сα):
Как видно из схемы, для удаления протона необходимо основание.
Реакция Е1 также протекает по правилу Зайцева.
Химические свойства полигалогенпроизводных:
Все реакции моногалогенпроизводных:
1. Гидролиз:
Геминальные ГПУ менее реакционно способны и реагируют при более жестких условиях в присутствие серной кислоты при нагревании:
Применение:
Четыреххлористый углерод.
Применяется как негорючий растворитель, в частности при тушении пожаров, если горят жидкости с плотностью ниже 1 – легче воды.
1. Служит для получения фреона-12.
2. Применяется для проведения химических анализов в лабораториях нефтехимической отрасли (определение нефтепродуктов в оборотных и сточных водах, в качестве экстрагента).
1,2- Дихлорэтан.
1. Исходный продукт для синтеза хлористого винила в промышленности пластмасс (дешевый, но ядовитый растворитель).
2. В промышленности 1,2-дихлорэтан используется как растворитель жиров, восков, смол,парафинов и других веществ.
3. Его применяют и в химических лабораториях для экстракции многих органическихвеществ из водных растворов.
4. 1,2-Дихлорэтан используется для извлечения жира из шерсти животных, для химчистки одежды.
Гексахлорэтан.
1. Применяется как инсектицид (хранится в запаянном капилляре) – средство для борьбы с вредными насекомыми, в агрономии.
2. Применяется в ветеренирии, в качестве глистогонного средства.
3. В производстве дымовых шашек.
4. Используется в производстве хладона-113.
5. В производстве таблеток для дегазации помещений и местности.
Большое применение в технике охлаждения получили полифторхлоруглеводороды (фреоны). Фреона – очень устойчивые соединения, они не гидролизуются и поэтому не корродируют металл; используются как хладогенты, как растворители инсектофунгецидов для образования аэрозолей и как промежуточные продукты в синтезе фторпроизводных.
Важное применение получил фторотан СF3 – CHClBr – бесцветная тяжелая жидкость с запахом, напоминающим хлороформ. Это одно из самых эффективных средств для общего наркоза. Имеет ряд преимуществ перед хлороформом: мало токсичен, почти не дает стадии возбуждения, наркоз быстро проходит.
