Номенклатура, изомерия, строение, способы получения и химические свойства предельных галогенпроизводных. Отдельные представители
Рациональная номенклатура:
Названия моногалогенпроизводных часто производят от названий соединенных с галогеном радикалов с добавлением прилагательного, образованного из названия галогена: иодистый метил, бромистый изопропил, хлористый винил и т. п.
Систематическая: Названия галогенопроизводных по систематической номенклатуре образуют из названий соответствующих им предельных углеводородов, добавляя название галогена с цифрой, указывающей его положение в цепи. Простейшие галогенопроизводные называют по входящим в них радикалам:
CH3-Cl хлорметан, хлористый метил
CH3-CH2Cl хлорэтан, хлористый этил
CH3-CH2-CH2Cl 1-хлорпропан, хлористый пропил
ГПУ нумеруют с того конца, к которому ближе всего расположен галоген:
СН3-СН-СН-СН3
Cl Cl
2-хлор-3-метилбутан
Изомерия:
Структурная изомерия:
Изомерия галогенопроизводных зависит от строения углеводородного скелета и положения атома галогена в цепи. Следовательно, галогенопроизводные имеют большее число изомеров, чем предельные углеводороды. Изомерия начинается с третьего члена ряда.
Оптическая изомерия:
Возникает у молекул, в которых имеется асимметричный атом углерода, имеющий 4 различных заместителя. При этом возникает 2 изомера:
d(+) l(-)
(S-конфигурация) (R-конфигурация)
d- вращает плоскость поляризованного света вправо, l - влево.
Строение:
Моногалогенпроизводные предельных углеводородов называют галогеналкилами.
Возможны три типа галогенпроизводных: первичные — в них галоген находится при углероде, связанном только с одним углеводородным радикалом; вторичные — галоген находится при углероде, связанном с двумя углеводородными радикалами;третичные — галоген расположен при углероде, соединенном с тремя радикалами. Например, существуют четыре хлорпроизводных бутана:
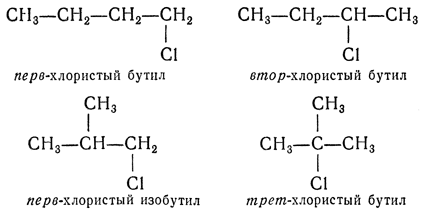
Способы получения
1. Получение моногалогенопроизводных из предельных углеводородов реакцией замещения атомов водорода галогенами — наиболее важный технический метод.
2. Присоединение галогеноводородов к олефинам идет обычно на холоду . Этот способ особенно удобен для получения моногалогенопроизводных, так как реакция не сопровождается образованием побочных продуктов — по- лигалогенопроизводных, как это происходит при использовании первого метода.
3. Очень часто галогенопроизводные получают замещением гидрокси- льной группы спиртов галогеном:
а) действием галогеноводородов
R-OH+HCl↔ R-Cl+H2O
Или
R-OH+KBr+H2SO4↔R-Br+KHSO4+H2O
б) галогенидов фосфора
R—ОН+РС15↔R—CI+HCI+POCI3,
3R—OH+POCI3↔3R—С1+РО(ОН)3;
в) хлористого тионила
R-OH+SOCl2↔RO-SO-Cl+HCl
RO-SO-Cl↔R-Cl+SO2
При работе с РС13 в качестве побочного продукта образуется сложный эфир P(OR)3.
Галогениды фосфора иногда получают непосредственно в реакционной системе взаимодействием красного фосфора с бромом или иодом.
Легче всего замещается галогеном гидроксил у третичного атома углерода. В этом случае часто достаточно взболтать спирт с концентрированной галогеноводородной кислотой. В первичных спиртах гидроксил при действии галогеноводородов замещается только в присутствии катализаторов: кислот, галогенидов цинка и т. д.
Применение хлористого тионила SOCI2 для получения хлоралкилов особенно удобно, так как все побочные продукты этой реакции — растворимые в воде газы, которые легко отделяются от полученного гало- геналкила.
4. Моногалогенопроизводные получают действием галогенов на сухие серебряные соли карбоновых кислот. При этом углеродная цепь укорачивается на один углеродный атом:
Hlg2
R-COOAg ↔ R-COOHlg↔ R-Hlg
-CO2
5. Фтористые алкилы получают обменной реакцией из хлористых, бромистых или иодистых алкилов действием фторидов Hg, Ag, Со, Sb и др. Например:
2C2H5Br+HgF2↔2C2H5F+HgBr2
Реакции между хлористыми и бромистыми алкилами и KF в обычных условиях не проходят. Однако их можно провести взаимодействием KF с галогеналкилами в бензоле в присутствии краун-эфира — 8-краун-6 (гл. 4.2). С хорошим выходом и в мягких условиях обменные реакции можно проводить с помощью ионообменных смол.
Хим свойства:
ГПУ – имеют 3 реакционных центра:
Введение электроно-донорных заместителей ускоряет реакцию, электроно-акцепторных – замедляет.
1. Гидролиз ГПУ:
