Основные положения теории электролитической диссоциации. Кислоты, основания и соли как электролиты.
Самостоятельная работа с учебником Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил. Страница 65, 66.
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс .
Вещества, распадающиеся на ионы, называют электролитами. Электролиты – вещества с ионной или сильно ковалентной связью: кислоты, основания, соли. остальные вещества – неэлектролиты; к ним относятся вещества с неполярной или слабо полярной ковалентной связью; например, многие органические соединения.
Теория Электролитической диссоциации:
1. при растворении в воде электролиты распадаются на положительные ионы (катионы) и отрицательные ионы (анионы). ионы в растворе взаимодействуют с молекулами воды (гидратация). Процесс диссоциации является обратимым.
2. под действием постоянного электрического тока катионы движутся по катоду, анионы – к аноду.
3. степень диссоциации зависит от природы электролита и растворителя, концентрации электролита и температуры.
Степень диссоциации (а) – отношение числа молекул, распавшихся на ионы (N’) к общему числу растворенных молекул (N): а = N’/ N;
Сильный электролит – вещество, степень диссоциации которого больше 30%.. к сильным электролитам относят все соли , сильные кислоты, сильные основания.
Слабый электролит – вещество, степень диссоциации которого меньше 3%. к слабым электролитам относят слабые кислоты, слабые основания.
степень диссоциации зависит от концентрации вещества в растворе, поэтому некоторые слабые электролиты при разбавлении могут стать сильными.
константа диссоциации – константа равновесия электролитической диссоциации. она равна отношению произведений концентраций ионов, образующихся при диссоциации, к концентрации исходных частиц.
Уравнения химических реакций:
а) СuSO4 + Ba(NO3)2 = Cu(NO3)2 + BaSO4 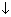 ;
;
б) СuSO4 + BaСl2 = CuCl2 + BaSO4 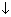 ;
;
в) СuSO4 + 2NaOH = Na2SO4 + Cu(OH)2 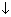 ;
;
г) AgNO3 + HCl = HNO3 + AgCl 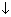 ;
;
е) AgNO3 + NaCl = NaNO3 + AgCl 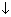 .
.
На основании этих реакций можно сделать следующие выводы:
1) ионы металлов, гидроксильные группы и кислотные остатки реагируют в водных растворах как самостоятельно существующие частицы;
2) гидроксильные группы, кислотные остатки, атомы водорода кислот и атомы металлов солей являются теми электрически заряженными частицами, которые находятся в растворах кислот, щелочей и солей.
Поскольку число молекул воды, которое присоединяют ионы, неизвестно, то процесс диссоциации кислоты, щелочей и солей упрощенно можно изображать так:
HCl = H+ + Cl–,
NaOH = Na+ + OH–,
NaCl = Na+ + Cl–.
Многоосновные кислоты и кислые соли диссоциируют ступенчато. Чтобы показать неполную диссоциацию молекул и ионов, не относящихся к сильным электролитам, используют знак обратимости « 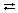 ». Например, для H2SO4 и ее кислой соли NaHSO4:
». Например, для H2SO4 и ее кислой соли NaHSO4:
H2SO4 = H+ + HSO4-
HSO4- 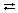 H+ + SO42-
H+ + SO42-
NaHSO4 = Na+ + HSO4-
HSO4- 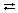 H+ + SO42-
H+ + SO42-
Следует запомнить и не допускать ошибок при написании уравнений диссоциации нерастворимых и малорастворимых веществ, которые практически не диссоциируют на ионы или диссоциируют в малой степени:
CaCO3 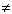 нет диссоциации,
нет диссоциации,
СuSO4 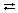 Cu2+ + SO42-
Cu2+ + SO42-
Учитывая диссоциацию в растворах, уравнения многих реакций можно записать в сокращенном ионном виде. Ионное уравнение показывает, какие именно ионы участвуют в реакции. Например, полное уравнение реакции AgNO3 AgCl + NaNO + NaCl =3 можно записать в сокращенном ионном виде: Ag+ + Cl– = AgCl. Суть реакции состоит в образовании осадка AgCl при встрече ионов Ag+ и Cl–, тогда как ионы Na+ и NO3– остаются в растворе и фактически не принимают участия в реакции.
Вопросы для самоконтроля
- Какие типы химических реакций Вы знаете?
- Что такое ионы?
- Какие ионы бывают?
- Что такое реакции ионного обмена?
Отвечать на вопросы учебника: Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов, страница 67.
ПЛАН ЗАНЯТИЯ № 13
Дисциплина: Химия.
Тема:Кислоты.
Цель занятия: Закрепить и обобщить знания учащихся об особенностях класса неорганических веществ – кислот. Познакомить учащихся с химическими свойствами кислот. Показать использование на уроках химии электрохимического ряда напряжения металлов и таблицы растворимости
Планируемые результаты
Предметные: владение основополагающими химическими понятиями, теориями, законами и закономерностями; сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
Метапредметные: применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени:2 часа
Вид занятия:Лекция.
План занятия:
1. Кислоты как электролиты, их классификация по различным признакам.
2. Химические свойства кислот в свете теории электролитической диссоциации. Особенности взаимодействия концентрированной серной и азотной кислот с металлами.
3. Основные способы получения кислоты.
Оснащение: Таблица растворимости, Периодическая система химических элементов, ряд активности металлов.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Тема 13. Кислоты.
План:
1. Кислоты как электролиты, их классификация по различным признакам.
2. Химические свойства кислот в свете теории электролитической диссоциации.
3. Особенности взаимодействия концентрированной серной и азотной кислот с металлами.
4. Основные способы получения кислоты.
