V2: Электролиты. Теория электролитической диссоциации.
V2: Сильные электролиты. Ионная сила раствора. Теория Дебая- Хюккеля.
I:
S:математическое выражение Предельного закона Дебая-хюккеля имеет вид
-: 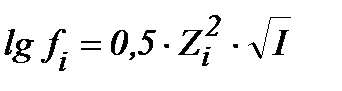
- 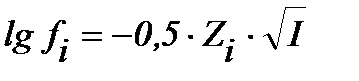
-: 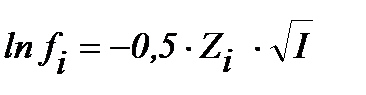
-: 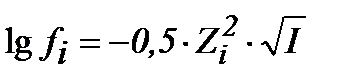
I:
S: Формула для расчета ионной силы раствора, в котором в качестве растворенного компонента хлорид алюминия, имеет вид:
-:I=(1/2)*[C(Cl-)*12+ C(Al3+)*32]
-: I=[C(Cl-)*12+ C(Al3+)*32]
-: I =(3/2)*[C(Cl-)*12+ C(Al3+)*32]
-: I =[C(Cl-)I2+ C(Al3+)312]
I:
S: Коэффициент активности для ионов кальция в 0,1 М растворе равен 0,36. Активность ионов кальция в таком растворе равна
-: 0,036
-: 3,6
-: 0,278
-: 0,0278
I:
S: Коэффициент активности для хлорид-иона 0,1 М растворе хлорида кальция равно 0,75. Активность хлорид-иона в таком растворе равна
-: 0,15
-: 0,075
-: 0,035
-: 7,5
I:
S: Cувеличением концентрации сильного электролита в разбавленном растворе значение коэффициента активности иона
-: увеличивается
-:уменьшается
-: не меняется
I:
S: При бесконечном разбавлении значение коэффициента активности иона стремится к
-: 1
-: 0
-: 100%
-: ∞
I:
S: К сильным электролитам относятся соединения с: а) ионной связью; б) сильно полярной ковалентной связью; в) мало полярной ковалентной связью; г) неполярной ковалентной связью.
-: а
-: а, б
-: а, б, в
-: а, б, в, г
I:
S: В физиологическом растворе концентрация хлорида натрия составляет 0,15 М. Ионная сила такого раствора
-:I=(1/2)* ( 0,15*12+0,15*12)=0,15
-: I=( 0,15*12+0,15*12)=0,3
-: I=(1/2)*(0.1*22+0.1*22)=0,4
-: I=(0.1*22+0.1*22)=0,8
I:
S: В физиологическом растворе концентрация хлорида натрия составляет 0,15М.Коэффициент активности ионов натрия в таком растворе 0,805. Активность ионов натрия в таком растворе
-: 0,127
-: 0, 15
-: 0,075
-: 0,3
I:
S: Водный раствор с массовой долей сульфата меди(II) 1% (ƥ = 1,009 г/мл) назначают в малых дозах для улучшения кроветворной функции. Вычислите активность ионов меди в таком растворе (Т = 298 К).Коэффициент активности ионов меди в таком растворе 0,405.
-: 0, 255
-: 0,037
-: 0.05
-: 0,0255
I:
S: Раствор хлорида кальция используется в качестве противоаллергического, противовоспалительногосредства. Потенциометрическим методом установлено, что активность ионов кальция в таком растворе 0,22 моль/л. Вычислите молярную концентрацию ионов кальция, если коэффициент активности ионов кальция 0,45.
-: 0,099
-: 0,488
-:2.04
-: 0,15
V2: Гидролиз солей
I:
S: Какие из солей подвергаются гидролизу по аниону?
А. КСlO Б. СаСl2 В. FeCl3 Г. КNO2Д. КNO3
-: АБ
-:АГ
-: ГД
-: БВ
I:
S: Какие из солей подвергаются гидролизу по катиону?
А. КСlOБ. СаСl2В. FeCl3 Г. КNO2Д. Cu(NO3)2
-: АБ
-:ВД
-: ГД
-: БВ
I:
S: Какие из солей подвергаются гидролизу по катиону и аниону?
А. КСlOБ. NH4FВ. FeCl3 Г. КNO2Д. Al(CH3COO)3
-: АБ
-:БД
-: ГД
-: БВ
I:
S: Какие из солей гидролизуне подвергаются?
А. КСlO4Б. NH4FВ. FeCl3 Г. КNO3Д. Al(CH3COO)3
-: АБ
-:АГ
-: ГД
-: БВ
I:
S: Какие из солей в водном растворе создают рН>7?
А. КСlO Б. СаСl2 В. FeCl3 Г. КNO2Д. КNO3
-: АБ
-:АГ
-: ГД
-: БВ
I:
S: Какие из солей в водном растворе создают рН<7
А. КСlOБ. СаСl2В. FeCl3 Г. КNO2Д. Cu(NO3)2
-: АБ
-:ВД
-: ГВ
-:AГ
I:
S: В воде растворили сульфид калия. Выберите правильнуюсхему гидролиза этой соли по первой ступени в ионном виде
-: НS-+H2O ↔H2S+OH-
-:S-2 +H2O ↔HS- +OH-
-: S-2 +H2O ↔H2S+2OH-
-: НS- +H3O+↔Н2S+H2O
I:
S: В воде растворили сульфид калия. Выберите правильную схему гидролиза этой соли по второй ступени в ионном виде
-:НS-+H2O ↔H2S+OH-
-: S-2 +H2O ↔HS- +OH-
-: S-2 +H2O ↔H2S+2OH-
-: НS- +H3O+↔Н2S+H2O
I:
S: В воде растворили хлорид цинка. Выберите правильную схему гидролиза соли по первой ступени
-: ZnOH++H2O ↔Zn(OH)2+H+
-:Zn2+-+H2O ↔ZnOH++H+
-: Zn(OH)2 +2H3O+ ↔Zn2++4H2O
-: Zn2++4H2O ↔Zn(OH)2 +2H3O+
I:
S:Выберите правильный ответ. Выражение для константы гидролизахлорида магния по первой ступени имеет вид:
-: 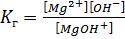
-: 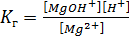
-: 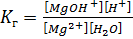
I:
S: Выберите правильный ответ. Выражение для константы гидролиза нитрата аммония имеет вид:
-: 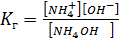
-: 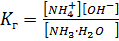
-: 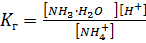
-: 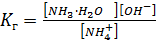
I:
S: Численное значение константы гидролиза для солей, образованных сильными кислотами и слабымиоднокислотными основаниями, вычисляется по формуле:
-: 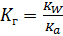
-: 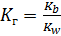
-: 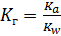
-: 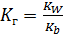
I:
S: Численное значение константы гидролиза для солей, образованных сильными кислотами и слабыми однокислотными основаниями, вычисляется по формуле:
-: 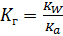
-: 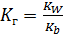
-: 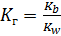
-: 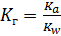
I:
S: Численное значение константы гидролиза для солей, образованных слабыми одноосновными кислотами и сильными основаниями, вычисляется по формуле:
-: 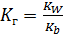
-: 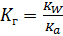
-: 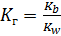
-: 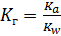
V2: Буферные растворы.
I:
S: Алкалоз – это
-: смещение окислительно-восстановительного процесса в биологических жидкостях в сторону накопления восстановителей
-: смещение кислотно-основного равновесия в организме в кислую область
-:смещение кислотно-основного равновесия в организме в щелочную область
-: смещение окислительно-восстановительного процесса в биологических жидкостях в сторону накопления окислителей
I:
S: Ацидоз – это
-: смещение окислительно-восстановительного процесса в биологических жидкостях в сторону накопления восстановителей
-:смещение кислотно-основного равновесия в организме в кислую область
-: смещение кислотно-основного равновесия в организме в щелочную область
-: смещение окислительно-восстановительного процесса в биологических жидкостях в сторону накопления окислителей
I:
S: Зоной буферного действия называется
-: интервал значений рН, в котором система не проявляет буферные свойства
-:интервал значений рН, в котором система проявляет буферные свойства
-: зона, отвечающая максимальному значению рН
-: зона, отвечающая минимальному значению рН
I:
S: Определите, какие из перечисленных систем обладают буферными свойствами? А. НSO4-/SO42-Б. СН3СООН/СН3СОО- В. Н2PO4-/ НPO42- Г. Н2СО3 /НСО3- Д. ОН-/NaOH
-: АДБ
-:БВГ
-: АБВ
-: ВГД
I:
S: Определите, какие из перечисленных систем не обладают буферными свойствами? А. НSO4-/SO42-Б. СН3СООН/СН3СОО- В. Н2PO4-/ НPO42- Г. Н2СО3 /НСО3- Д. ОН-/NaOH
-:АД
-: БВ
-: АБ
-: ВД
I:
S: pKa(CH3COOH) =4,74. Не будут обладать буферными свойствами ацетатный раствор с рН
-: 5,0
-:6,5
-: 4,7
-: 4,5
I:
S: pKa1(H2CO3) =6,36. Не будут обладать буферными свойствами гидрокарбонатный раствор с рН
-: 5,5
-:8,5
-: 7,2
-: 7,0
I:
S: Формула Гендерсона – Гассельбаха для буферных растворов I-го типа имеет вид:
-: 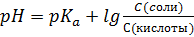
-: 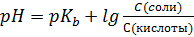
-: 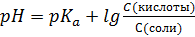
-: 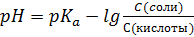
I:
S: Формула Гендерсона – Гассельбаха для буферных растворов II-го типа имеет вид:
-: 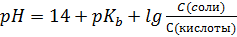
-: 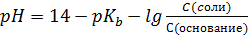
-: 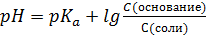
-: 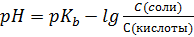
I:
S: СмешалиV(СH3COOH) млcконцентрацией уксусной кислоты С(СH3COOH)и V(СH3COONa)с концентрацией С(СH3COONa). Формула для расчета рН буферного раствора будет иметь вид:
-: 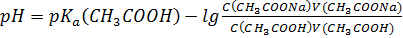
-: 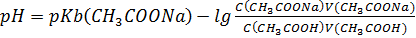
-: 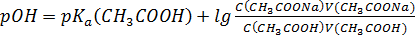
-: 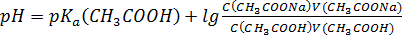
I:
S: В результате гипервентиляции рН крови составило 7,5.
Такое состояние называют:
-: респираторным (газовым) ацидозом
-: метаболическим алкалозом
-: респираторным (газовым) алкалозом
-: метаболическим ацидозом
I:
S: В фосфатном буфере выполняет роль слабой кислоты
-:гидрофосфат натрия
-: ортофосфорная киcлота
-:дигидрофосфат натрия
-: фосфат натрия
I:
S: Буферная емкость максимальна при мольном соотношении компонентов: -: больше единицы
-:равном единице
-: меньше единицы
-: равном 7
I:
S: Буферная система, которая находится и в плазме и в эритроцитах:
-: гидрокарбонатная
-: гемоглобиновая
-:оксигемоглобиновая
-: протеиновая
I:
S: СмешалиV(СH3COOH) мли V(СH3COONa) с одинаковыми молярными концентрациями. Формула для расчета рН буферного раствора будет иметь вид:
-: 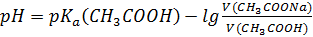
-: 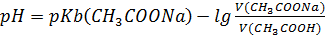
-: 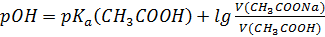
-: 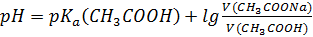
I:
S: При поступлении в кровь кислотных продуктов метаболизма содержание СО2 в плазме крови:
-: уменьшается
-:увеличивается
-: остается неизменной
I:
S: У больных сахарным диабетом развивается метаболический ацидоз за счѐт накопления кетоновых тел в виде β-гидроксомасляной кислоты и ацетоуксусной кислот.
Какой режим дыхания можно рекомендовать таким больным?
-:глубокое дыхание
-: поверхностное дыхание
I:
S: При неудержимой рвоте в организме возникает метаболический алкалоз за счѐт потери кислотных компонентов желудочного сока. Какой режим дыхания следует рекомендовать в этом случае?
-: глубокое дыхание
-:поверхностное дыхание
-: дыхание разреженным воздухом
I:
S: Буферная емкость – количество молей эквивалента кислоты или щелочи, которое нужно добавить 1 литру буферного раствора, чтобы изменить величину рН на
-: 0.5 ед.
-: 2.0 ед.
-: 1.0 ед.
-: 1.5 ед.
V2: Электролиты. Теория электролитической диссоциации.
I:
S: понятию «степень диссоциации» соответствует определение
-: стехиометрическое отношение концентраций образовавшихся ионов
-: отношение концентрации анионов к концентрации недиссоциированной части молекул
-: отношение числа диссоциированных молекул к числу недиссоциированных молекул
-:отношение числа диссоциированных молекул к общему числу молекул растворенного вещества
-: отношение числа недиссоциированных молекул к числу молекул, подвергшихся диссоциации
I:
S: Выбрать строку, где все представленные вещества являются электролитами
-: хлорид натрия, сахароза, серная кислота, углекислый газ
-: гидроксид калия, уксусная кислота, нитрат натрия, сульфид калия
-: бромид железа(III), оксид марганца(IV), этанол, перманганат калия
-: глюкоза, сернистая кислота, оксид серы (VI), гидроксид кальция
I:
S: Диссоциация хлористой кислоты может представлена следующей схемой
-: HCl →H+ +Cl-
-: HClO2 ↔H+ +ClO2-
-: HClO ↔H+ +ClO-
-: HClO→H+ +ClO-
I:
S: Электролитическая диссоциация нитрата железа(III) представлена схемой
-: Fe(NO3)3→Fe(NO3)2++NO3-
-: Fe(NO3)3→Fe(NO3)2++2 NO3-
-:Fe(NO3)3→Fe3++3NO3-
-: Fe(NO3)3↔Fe3++3NO3-
I:
S: Из 500 молекул пропионовой кислоты в водном растворе 10 молекул кислоты, подверглась диссоциации. Пропионовая кислота является электролитом
-: средней силы
-: слабым по силе электролитом
-: сильным
-: изотоническим
I:
S: Из 100 молекул муравьиной кислоты в водном растворе 1 молекула кислоты, подверглась диссоциации. Муравьиная кислота является электролитом
-: средней силы
-: слабым
-: сильным
-: изотоническим
I:
S: Из 200 молекул сернистой кислоты в водном растворе 20 молекул продиссоциировали. Сернистая кислота является электролитом
-: средней силы
-: слабым
-: сильным
-: изотоническим
I:
S: Электролитическая диссоциация нитрита кальция представлена схемой
-: Са(NO2)2→Са(NO2)++NO2-
-: Са(NO3)3→Са(NO3)2++2 NO3-
-:Са(NO2)2→Са2++2NO2-
-: Са(NO2)2↔Са2++2NO2-
I:
S: Степень диссоциации электролита в водном растворе равна 5 %. Из 200 молекул этого электролита диссоциации подверглось
-: 5 молекул
-: 1 молекула
-: 10 молекул
-: 100 молекул
I:
S: Степень диссоциации электролита в растворе увеличивается
-: при увеличении концентрации раствора
-: при разбавлении раствора
-: при понижении температуры раствора
-: при введении одноименного иона
I:
S: Степень диссоциации электролита в растворе увеличивается
-: при увеличении концентрации раствора
-: при понижении температуры раствора
-: при повышении температуры раствора
-: при введении одноименного иона
I:
S: Степень диссоциации электролита в растворе увеличивается
-: при увеличении концентрации раствора
-: при понижении температуры раствора
-: при замене растворителя с большим значением диэлектрической проницаемости
-: при введении одноименного иона
I:
S: Степень диссоциации электролита в растворе уменьшится
-: при увеличении концентрации раствора
-: при разбавлении раствора
-: при повышении температуры раствора
I:
S: Муравьиная кислота диссоциирует по схеме HCOOH↔HCOO- + H+. Понизить степень диссоциации можно
-: при увеличении концентрации муравьиной кислоты
-: при разбавлении раствора муравьиной кислоты
-: при повышении температуры раствора
-: введениемв систему раствора щелочи
I:
S: Муравьиная кислота диссоциирует по схеме HCOOH↔HCOO- + H+. Понизить степень диссоциации можно
-: при разбавлении раствора муравьиной кислоты
-: при повышении температуры раствора
-:введением в систему раствора соляной кислоты
I:
S: Схема диссоциации водного раствора аммиака представлена схемой
-: 2NH3 →NH2- + NH4+
-: NH3 + H2O →NH4+ +OH-
-: NH3 + H2O ↔NH4+ +OH-
-: NH3 + H3O+ ↔NH4+ +H2O
I:
S: Константа диссоциации сероводородной кислоты по второй ступени имеет следующее выражение
-: Ka2 = [H+]2[S-2]/[H2S]
-: Ka2 = [H+][HS-]/[H2S]
-: Ka2 = [H+][S2-]/[HS-]
-: Ka2= [H+][S2-]2/[HS-]
I:
S: Константедиссоциации сероводородной кислоты по первой ступенисоответствует следующее выражение
-: Ka1 = [H+]2[S-2]/[H2S]
-: Ka1 = [H+][HS-]/[H2S]
-: Ka1 = [H+][S2-]/[HS-]
-: Ka1 = [H+][S2-]2/[HS-]
I:
S: Константа диссоциации угольной кислоты по первой ступени имеет следующее выражение
-: Ka1 = [H+]2[СO3-2]/[H2CO3]
-: Ka1 = [H+][HCO3-]/[H2CO3]
-: Ka1 = [H+][CO32-]/[HCO3-]
-: Ka1 = [H+][CO32-]2/[HCO3-]
I:
S: Константа диссоциации угольной кислоты по второй ступени имеет следующее выражение
-: Ka2 = [H+]2[СO3-2]/[H2CO3]
-: Ka2 = [H+][HCO3-]/[H2CO3]
-: Ka2 = [H+][CO32-]/[HCO3-]
-: Ka2 = [H+][CO32-]2/[HCO3-]
I:
S: Константа диссоциации хлорноватистой кислотыимеет следующее выражение
-: Ka = [H+][СlO-]/[H2ClO]
-:Ka = [H+][СlO-]/[HClO]
-: Ka = [H+]-]/[HClO] [СlO-]
-: Ka= -[HClO]/ [СlO-][H+]-
I:
S: силакислот HCN (Ka= 6,2∙10-10), CH3COOH (Ka= 1,8∙10-5), HClo (Ка= 8∙10-9), H2CO3(Ка1=4,5∙10-7) убываетвряду
-:CH3COOH >HClo> H2CO3> HCN
-:HClo> HCN > CH3COOH > H2CO3
-:CH3COOH > H2CO3> HCN >HClo
-:CH3COOH > H2CO3>HClo> HCN
-:H2CO3> CH3COOH >HClo> HCN
I:
S:закон разведения оствальда в математической форме имеет вид
-: 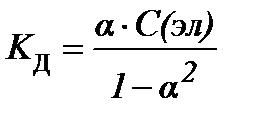
-: 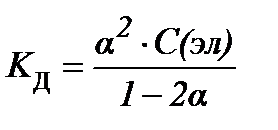
-: 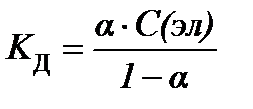
-: 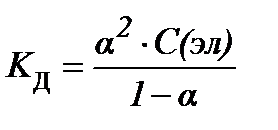
-: 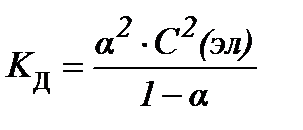
I:
S: Вычислить степень диссоциации гликолевой кислоты в 0,01 М растворе, если Ка=10-6.
-: 0,001
-: 0,01
-: 0,1
I:
S: В растворе ортофосфорной кислоты в наибольшем количестве присутствуют частицы
-:Н3 РО4
-: Н2 РО4-
-: НРО42-
-: РО43-
I:
S: Сумма коэффициентов в уравнении электролитической диссоциации сульфата алюминия равна
-: 3
-: 4
-: 5
-: 6
I:
S: Сумма коэффициентов в уравнении электролитической диссоциации нитрата железа (III) равна
-:3
-: 4
-: 5
-: 6
