Электрические свойства молекул
Все изменения, происходящие с молекулой в электрическом поле, принято называть поляризацией.Количественную характеристику свойства молекулы поляризоваться называют поляризуемостью. Полярная молекула характеризуется дипольным моментом m, величина которого выражается в единицах Дебая (Д), или в Кл×м. 1Д = 3.336×10-30 Кл×м. Если молекула неполярная μ = 0.
При помещении неполярной молекулы в электрическое поле происходит деформация молекулы: смещение отрицательных (электронов) и положительных (ядерной плотности) зарядов друг относительно друга, в результате чего молекула приобретает индуцированный(наведенный) дипольный моментμинд, величина которого зависит от напряженности электрического поля Е:
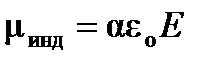 , (4.1)
, (4.1)
где e0 – диэлектрическая проницаемость вакуума.
Коэффициент пропорциональности  называют поляризуемостьюмолекулы, единицы измерения
называют поляризуемостьюмолекулы, единицы измерения 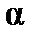 – м3 (см3). Эта величина складывается из поляризуемости ядерной плотности
– м3 (см3). Эта величина складывается из поляризуемости ядерной плотности 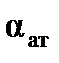 и поляризуемости электронного облака
и поляризуемости электронного облака 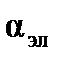 , т.е.
, т.е. 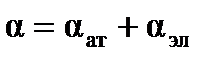 , причем
, причем 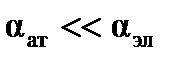 . Поляризуемоcть молекулы в первом приближении характеризует ее размер в системе СИ:
. Поляризуемоcть молекулы в первом приближении характеризует ее размер в системе СИ:
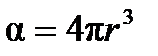 , (4.2)
, (4.2)
где r – эффективный радиус молекулы, м.
Полярная же молекула вследствие существования собственного дипольного момента при попадании в электрическое поле стремиться ориентироваться вдоль направления поля. Кроме того, в ней, как и в неполярной молекуле, возникает наведенный дипольный момент. В этом и заключается поляризация молекул.
В общем случае полная поляризуемость одного моля молекул в 1м3 (молярная поляризуемостьРm) складывается из поляризуемости ориентации, поляризуемости электронного облака и поляризуемости атомных ядер:
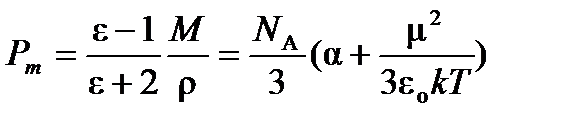 , (4.3)
, (4.3)
где e –относительная диэлектрическая проницаемость;
e0–диэлектрическая проницаемость вакуума 8,854×10-12 Ф/м;
М – молярная масса вещества;
r – его плотность;
NA – постоянная Авагадро, равная 6,02×1023моль-1 ;
k –постоянная Больцмана, равная 1,38×10-23 Дж/К.
Молярная поляризуемостьРm имеет единицы измерения молярного объема (м3/моль или см3/моль). Уравнение (4.3) носит название уравнения Дебая и справедливо в постоянном (статическом) электрическом поле для газообразных веществ.
Для неполярных молекул уравнение Дебая переходит в уравнение Клаузиуса-Мосотти:
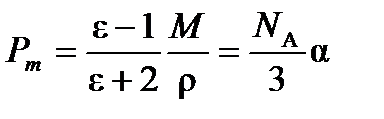 (4.4)
(4.4)
Уравнение Дебая можно записать в виде:
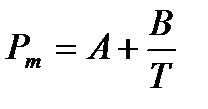 , (4.5)
, (4.5)
где 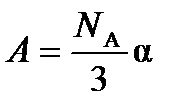 и
и 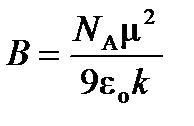 .
.
Таким образом, зная величины молярной поляризуемости при двух температурах, можно вычислить дипольный момент газовой молекулы и поляризуемость 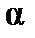 , а, следовательно, и эффективный радиус молекулы.
, а, следовательно, и эффективный радиус молекулы.
Пример: Молярная поляризуемость ацетона в газообразном состоянии составляет при 0оС 183.8×10-6 м3/моль, а при 30 оС 167.2×10-6 м3/моль. Вычислим дипольный момент и эффективный радиус молекулы.
Решение:
Из температурной зависимости молярной поляризуемости можно вычислить коэффициент В в уравнении (4.5)
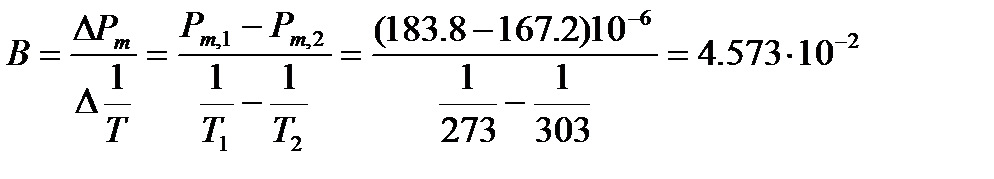 м3×К/моль
м3×К/моль
Тогда  Кл×м
Кл×м
Используя значение молярной поляризуемости при данной температуре и вычисленную величину В, легко определить параметр А иполяризуемость 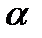 :
:
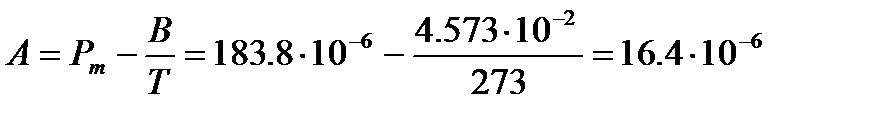 м3/моль
м3/моль
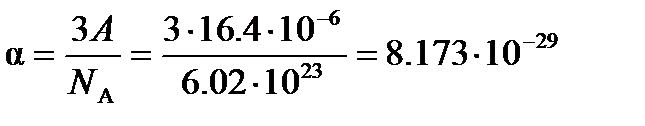 м3
м3
Следовательно, эффективный радиус молекулы, рассчитанный по уравнению (4.2), равен
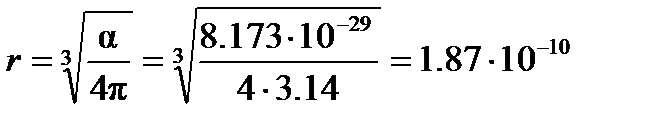 м.
м.
Поляризуемость молекулы зависит от частоты внешнего поля. Если частота поля n~ 1010 Гц, то полярные молекулы не успевают ориентироваться вдоль направления поля, и ориентационная составляющая поляризуемости исчезает. При n> 1013 Гц остается только электронная составляющая поляризуемости. При оптических частотах имеется простое соотношение между относительной диэлектрической проницаемостью при частоте n и показателем преломления n: en = n2n. Тогда
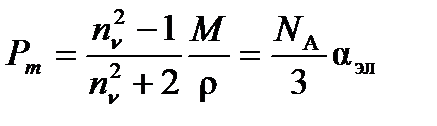 (4.6)
(4.6)
Молярную поляризуемость при оптических частотах называют молярной рефракциейR. Только рефракцию можно определить как отдельный вид поляризуемости. Показатель преломления зависит от длины волны падающего света. Обычно определяют показатель преломления при строго определенной длине волны, соответствующей D-линии спектра желтого натриевого пламени (l = 589.3 нм) –  . Таким образом, молярную рефракцию можно определить, измеряя показатель преломления и плотность вещества по формуле Лоренц –Лорентца:
. Таким образом, молярную рефракцию можно определить, измеряя показатель преломления и плотность вещества по формуле Лоренц –Лорентца:
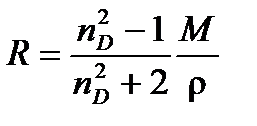 (4.7)
(4.7)
Единицы измерения молярной рефракции, естественно, такие же, как и у молярной поляризуемости, м3/моль (см3/моль).
Экспериментально установлено, что молярная рефракция молекулы приближенно является суммой рефракций отдельных атомов, ионов или связей, входящих в нее. Для вычисления молярной рефракции по аддитивной схеме наиболее часто используют систему атомных, групповых рефракций и инкрементов Ф. Эйзенлора (КС, таблица 91, с.156).
Пример:По экспериментальным данным и правилу аддитивности определим молярную рефракцию, вычислим электронную поляризуемость, дипольный момент и эффективный радиус молекулы ацетона, если молярная поляризуемость ацетона при 293К составляет 173×10-6 м3/моль, показатель преломления n=1.3591 и плотность r=0.7905×103 кг/м3.
Решение:
Молярная рефракция ацетона, вычисленная по правилу аддитивности, представляет собой сумму рефракций атомов углерода, водорода и кислорода, входящего в карбонильную группу. Используя значения атомных рефракций из таблицы 91 [КС], находим
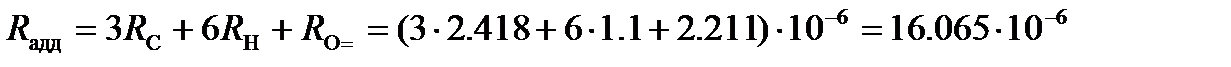 м3/моль.
м3/моль.
Величина молярной рефракции, рассчитанная по уравнению (4.7) с использованием экспериментальных данных, составляет
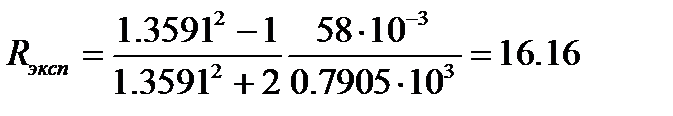
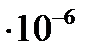 м3/моль.
м3/моль.
Так как 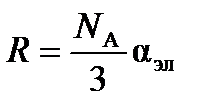 , то электронная составляющая поляризуемости равна
, то электронная составляющая поляризуемости равна
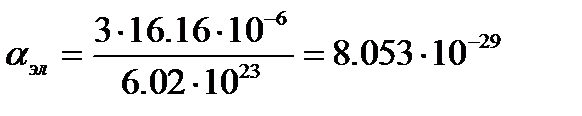 м3.
м3.
Пренебрегая малой величиной 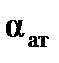 , можно считать
, можно считать 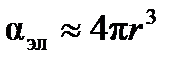 и рассчитать величину радиуса молекулы ацетона
и рассчитать величину радиуса молекулы ацетона
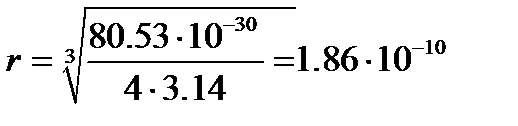 м.
м.
Приближенно можно записать, что
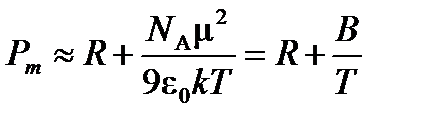
Тогда 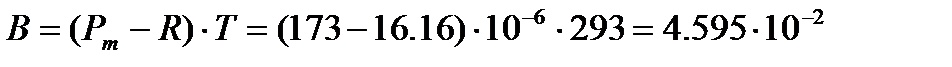 м3×К/моль, и дипольный момент молекулы ацетона
м3×К/моль, и дипольный момент молекулы ацетона
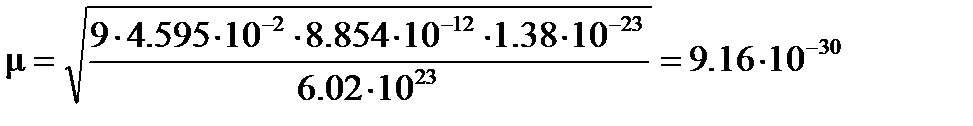 Кл×м.
Кл×м.
Используя свойство аддитивности молярной рефракции, можно решить вопрос о возможном строении молекул.
Пример: Элементарный состав органического соединения: С – 54.5%; O – 36.4%; Н – 9.1% (масс.). Молярная масса 88×10-3 кг/моль. Показатель преломления и плотность соответственно равны: n=1.398, r=0.955×103 кг/м3. Определим структурную формулу соединения.
Решение:
Определим количества атомов С, О и Н в соединении:
С: 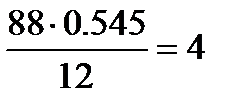 ; О:
; О: 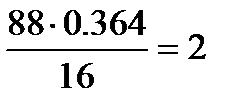 ; Н:
; Н: 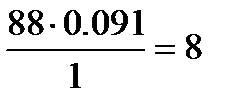 .
.
Следовательно, формула соединения С4Н8О2.
Для данного соединения возможны несколько структурных формул.
Например: кислота − СН3-СН2-СН2-СООН; непредельный двухатомный спирт - СН2=СН-СН2СН(ОН)2 и эфир СН3-СН2- СООСН3.
Для 1-го соединения величина молярной рефракции, вычисленная по правилу аддитивности, складывается из рефракций атомов углерода, рефракций атомов водорода и рефракций атома кислорода, входящего в карбонильную группу, и атома кислорода, входящего в гидроксильную группу:
R1 = (4×2.418 + 8×1.1 + 2.211 + 1.525) ×10-6 = 22.208×10-6 м3/моль.
Для 2-го соединения величина молярной рефракции представляет собой сумму рефракций атомов углерода, рефракций атомов водорода, рефракций атомов кислорода, входящих в гидроксильную группу, и рефракцию двойной связи:
R2 = (4×2.418 + 8×1.1 + 2×1.525 + 1.733) ×10-6 = 23.255×10-6 м3/моль.
Для расчета молярной рефракции 3-го соединения суммируем рефракции атомов углерода, водорода и рефракцию атомов кислорода, входящего в карбонильную группу, и кислорода, входящего в эфирную группу:
R3 = (4×2.418 + 8×1.1 + 2.211 + 1.643) ×10-6 = 22.326×10-6 м3/моль.
Величина молярной рефракции, вычисленная по экспериментальным данным, составляет:
Rэксп = 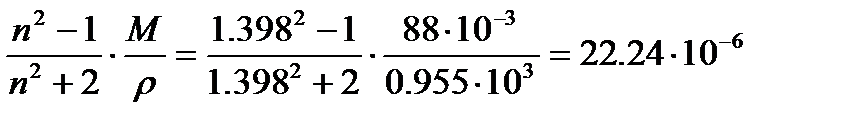 м3/моль.
м3/моль.
Наилучшее совпадение RэкспcR1. Следовательно, структурная формула соединения СН3-СН2-СН2-СООН.
На практике часто пользуются удельной рефракциейr, т.е. рефракцией единицы массы вещества
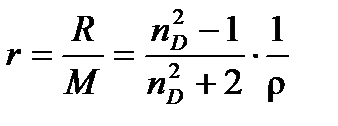 (4.8)
(4.8)
Единицы измеренияr – м3/кг или см3/г. Подобно молярной, удельная рефракция смеси тоже аддитивна: удельная рефракция смеси равна сумме удельных рефракций составляющих смесь веществ, умноженных на массовую долю вещества в смеси.
Для двухкомпонентного раствора можно записать:
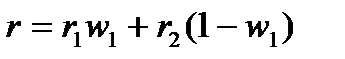 , (4.9)
, (4.9)
где r– удельная рефракция раствора;
r1 и r2 – удельные рефракции компонентов раствора;
w1 – массовая доля первого компонента в растворе.
Соотношение (4.9) часто используют для определения количественного состава двухкомпонентной смеси.
Пример: Найдем процентное содержание бензола в смеси с нитробензолом, если удельная рефракция смеси равна 0.287×10-3 м3/кг. Плотность и показатель преломления при 20оС соответственно равны: бензола – 0.879×103 кг/м3 и 1.5011; нитробензола – 1.2033×103 кг/м3 и 1.5524.
Решение:
Удельная рефракция бензола, вычисленная по уравнению (4.8), равна
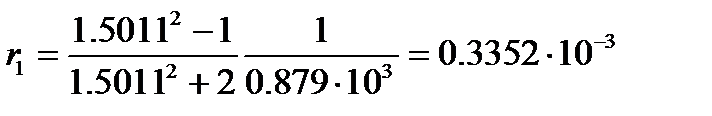 м3/кг,
м3/кг,
а удельная рефракция нитробензола
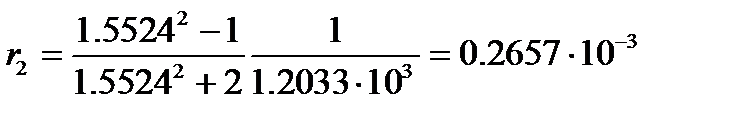 м3/кг
м3/кг
Тогда массовая доля бензола, рассчитанная по (4.9), составит
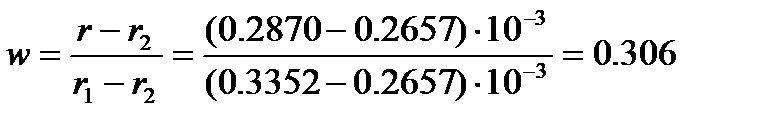
Состав смеси: 30.6% бензола и 69.4% нитробензола.
4.1.1 Многовариантное задание № 10 «Электрические свойства молекул»
Рассчитать дипольный момент и эффективный радиус молекулы С на основании экспериментальных значений молярной поляризуемости при заданной температуре t (таблица 4.1). При расчете пренебречь величиной атомной составляющей поляризуемости, молярную рефракцию вычислить по правилу аддитивности.
4.1.2. Контрольные вопросы
1. Какие изменения происходят в неполярной молекуле при ее помещении в постоянное электрическое поле?
2. Чем отличается поляризация полярной молекулы от поляризации неполярной молекулы при ее помещении в постоянное электрическое поле?
3. Из каких экспериментальных данных можно рассчитать величину молярной поляризуемости молекулы?
4. В чем заключается поляризации молекул в высокочастотном переменном электрическом поле? Как называется молярная поляризуемость молекулы в высокочастотном электрическом поле?
5. Как, используя электрические свойства молекулы, оценить ее ориентировочный радиус?
6. Какое свойство молярной рефракции используется для определения структурной формулы молекулы? Как определить структурную формулу молекулы?
7. Как определить дипольный момент молекулы, используя уравнение Дебая?
8. Как определить количественный состав раствора, используя удельную рефракцию раствора? Какие экспериментальные данные для этого необходимы?
Таблица 4.1 - Варианты заданий
| Вариант | Молекула С | Подвариант | |||||||||||
| t,oC | Pm×106, м3/моль | t,oC | Pm×106, м3/моль | t,oC | Pm×106, м3/моль | t,oC | Pm×106, м3/моль | t,oC | Pm×106, м3/моль | t,oC | Pm×106, м3/моль | ||
| Бромбензол | 72.82 | 72.00 | 71.15 | 70.38 | 69.63 | 68.92 | |||||||
| Хлорбензол | 74.16 | 73.17 | 72.23 | 74.68 | 71.33 | 68.85 | |||||||
| Фенол | 53.96 | 53.51 | 52.97 | 52.71 | 52.45 | 52.20 | |||||||
| Диэтиловый эфир | 45.83 | 45.18 | 44.57 | 44.27 | 43.71 | 43.43 | |||||||
| Дихлорметан | 66.62 | 65.84 | 64.36 | 62.97 | 61.65 | 59.23 | |||||||
| Диброметан | 88.79 | 85.04 | 83.31 | 81.68 | 78.66 | 75.93 | |||||||
| Диметиловый эфир | 52.27 | 49.24 | 47.13 | 48.15 | 45.26 | 44.39 | |||||||
| Ацетальдегид | 129.11 | 123.13 | 117.72 | 115.20 | 110.52 | 108.33 | |||||||
| Ацетонитрил | 274.27 | 270.65 | 263.70 | 250.85 | 233.85 | 223.74 | |||||||
| Хлорэтан | 97.71 | 91.41 | 87.03 | 85.03 | 81.34 | 78.03 | |||||||
| Бромэтан | 90.66 | 86.72 | 84.91 | 81.57 | 78.55 | 75.81 | |||||||
| Дихлорэтилен | 162.23 | 155.03 | 148.52 | 142.62 | 158.54 | 145.50 | |||||||
| Этанол | 61.46 | 60.12 | 58.86 | 56.52 | 53.43 | 49.16 | |||||||
| Пропанол | 61.28 | 59.05 | 56.11 | 54.37 | 52.04 | 51.33 | |||||||
| Этиленгликоль | 76.56 | 75.91 | 75.27 | 74.95 | 74.04 | 72.86 | |||||||
| Нитробензол | 249.91 | 247.61 | 245.35 | 240.97 | 236.77 | 232.72 | |||||||
| Хлорэтилен | 54.78 | 53.61 | 51.47 | 49.56 | 47.85 | 46.30 | |||||||
| Бромэтилен | 56.07 | 54.95 | 52.90 | 51.07 | 49.42 | 47.93 | |||||||
| Формальдегид | 87.56 | 79.02 | 75.84 | 74.35 | 72.92 | 68.98 | |||||||
| Бромметан | 74.74 | 72.93 | 71.23 | 69.63 | 68.11 | 66.67 | |||||||
| Метилацетат | 71.64 | 70.07 | 68.59 | 65.86 | 63.41 | 60.17 | |||||||
| Метанол | 60.18 | 57.97 | 56.61 | 55.31 | 59.42 | 54.09 | |||||||
| Этилацетат | 78.67 | 77.12 | 75.65 | 74.26 | 72.91 | 71.68 | |||||||
| Иодэтилен | 53.58 | 52.69 | 51.05 | 49.59 | 48.27 | 47.09 | |||||||
| Метиламин | 45.71 | 42.96 | 41.06 | 40.18 | 39.36 | 38.58 | |||||||
| Диметиламин | 36.21 | 34.57 | 33.43 | 32.91 | 32.42 | 31.95 |
