Химические свойства оснований
1)Диссоциация
KOH D K+ + OH-
2) Взаимодействие оснований с кислотными оксидами:
2NaOH + CO2 = Na2CO3 + H2O
2Na+ + 2OH- + CO2 = 2Na+ + CO32- + H2O
2OH- + CO2 = CO32- + H2O
3)Взаимодействие оснований с кислотами (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + H2O
Ca2+ + 2OH- + 2H+ + 2Cl- = Ca2+ + 2Cl- + H2O
OH- + H+ = H2O
4)Взаимодействие щелочей с растворами солей:
3KOH + FeCl3 = Fe(OH)3$ + 3KCl
3K+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3$ + 3K+ +3Cl-
3OH- + Fe3+ = Fe(OH)3$
Сокращенные ионные уравнения этих взаимодействий еще раз показывают, что именно гидроксид-ионы (OH-) участвуют в реакциях со стороны оснований.
Соли.
Рассмотрим, что происходит при растворении солей в воде и запишем соответствующие уравнения.
Диссоциация солей:
NaCl " Na+ + Cl-
K2CO3 " 2K+ + CO32-
Диссоциация практически всех растворимых солей происходит сразу, полностью и необратимо. Таким образом, соли являются сильными электролитами. Общих ионов для разных солей в растворе нет.
Соли
– это сильные электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Химические свойства солей.
Соли вступают в реакции ионного обмена с кислотами, щелочами и другими солями при соблюдении условий необратимости.
Взаимодействие с кислотой:
H2SO4 + Pb(NO3)2 = PbSO4$ + 2HNO3
2H+ + SO42- + Pb2++2NO3- = PbSO4$ + 2H++ 2NO3-
Pb2+ + SO42- = PbSO4
$
H2SO4 + K2SO3 = K2SO4 + H2O + SO2#
2H+ + SO42- + 2K+ + SO32- = 2K+ + SO42-+ H2O + SO2#
2H+ + SO32- = H2O + SO2#
Взаимодействие со щелочью:
2NaOH +MgSO4 = Mg(OH)2$ + Na2SO4
2Na+ + 2OH- + Mg2+ + SO42- = Mg(OH)2$ + 2Na+ + SO42-
Mg2+ + 2OH- = Mg(OH)2$
NaOH + NH4NO3 = NaNO3 + NH3# + H2O
Na+ + OH- + NH4+ + NO3- = Na+ + NO3- + NH3# +H2O
NH4+ + OH- = NH3# +H2O
Взаимодействие растворов двух солей:
Ba(NO3)2 + Na2SO4 = BaSO4$ + 2NaNO3
Ba2+ + 2NO3-+ 2Na+ + SO42- = BaSO4$ + 2Na+ + 2NO3-
Ba2+ + SO42- = BaSO4$
AgNO3 + NaCl = AgCl$ + NaNO3
Ag+ NO3- + Na+ + Cl- = AgCl$ + Na+ + NO3-
Ag+ + Cl- = AgCl$
Соли в водном растворе могут вступать в реакции замещения с металлами, обладающими более высокой восстановительной способностью:
Zn + CuSO4 = ZnSO4 + Cu
Соли в растворе могу подвергаться гидролизу, вступая в химическую реакцию с водой.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуется слабый электролит.
Гидролиз соли – это разновидность ионообменной реакции. Реакция протекает в направлении, обратном реакции нейтрализации. Поэтому при гидролизе соли образуются кислота (или кислая соль) и основание (или основная соль), и обычно среда раствора становится соответственно щелочной или кислой. Будет ли соль подвергаться гидролизу и какое значение рН приобретет раствор, можно определить, зная силу кислот и оснований, которыми образована соль.
К сильным электролитам относят: а) практически все растворимые соли; б) кислоты: H2SO4, HNO3, HCl, HBr, HI, HClO4, HClO3, HMnO4, HCrO3; в) растворимые основания (щелочи) – гидроксиды металлов IA и IB групп периодической системы:
KOH, NaOH, LiOH, Ba(OH)2, Ca(OH)2. К слабым электролитам относят остальные кислоты и основания, воду и другие вещества.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются (KCl, Na2SO4, Ba(NO3)2 и др.). Среда водного раствора остается нейтральной.
Если растворимая соль содержит хотя бы один ион слабого электролита (основания, кислоты), то такая соль обязательно подвергается гидролизу; характер среды при этом соответствует более сильному электролиту, образовавшему соль. То есть соль сильного основания и слабой кислоты дает щелочную среду, рН > 7 (Na2CO3, K2SO3, (CH3COO)2Ba и др.); соль слабого основания и сильной кислоты дает кислую среду, рН < 7 (AlCl3, Zn(NO3)2, CuSO4 и др.). Если оба электролита слабые, то в зависимости от того, какой из них сильнее, среда становится слабокислой, нейтральной или слабощелочной.
Напишем уравнения гидролиза. Обычно уравнения гидролиза записывают в трех формах: сокращенной ионной, ионной и молекулярной. Удобнее начинать с сокращенной ионной формы, которая отражает сущность процесса гидролиза – взаимодействие ионов соли с водой. Необходимо помнить, что в реакции участвуют ион слабого электролита и одна молекула воды (H+OH-).
4. Соли, образованные слабым основанием и сильной кислотой
хлорид аммония NH4Cl
NH4+ + H2O D NH4OH + H+
NH4+ + Cl- + H2O D NH4OH + H+ + Cl-
NH4Cl + H2O D NH4OH + HCl
хлорид алюминия AlCl3
Al3+ + H2O D AlOH2+ + H+
Al3+ + 3Cl- + H2O D AlOH2+ + H+ + 3Cl-
AlCl3 + H2O D AlOHCl2 + HCl
Обычно реакция гидролиза с участием многозарядного иона протекает по более сложной схеме, включающей несколько стадий. Об этом следует помнить, но нет необходимости писать остальные стадии, так как первая достаточно полно характеризует процесс: образование иона Н+ указывает на кислую среду раствора, осадок Al(OH)3 не образуется, потому что гидролиз протекает преимущественно по первой стадии.
5.Соли, образованные сильным основанием и слабой кислотой
цианид калия KCN
CN- + H2O D HCN + OH-
K+ + CN- + H2O D HCN + K+ + OH-
KCN + H2O D HCN + KOH
сульфит калия K2SO3
SO32- + H2O D HSO3- + OH-
2K+ + SO32- + H2O D 2K+ + HSO3- + OH-
K2SO3 + H2O D KHSO3 + KOH
Наличие ионов ОН- указывает на щелочную среду раствора
6. Соли, образованные слабым основанием и слабой кислотой
ацетат аммония.CH3COONH4
CH3COO- + NH4+ + H2O D CH3COOH + NH4OH
CH3COONH4 + H2O D CH3COOH + NH4OH
Раствор в данном случае имеет нейтральную среду, так как степени
диссоциации продуктов гидролиза примерно равны.
Многие соли, образованные многозарядными (двух-, трехзарядными) ионами слабых оснований и слабых кислот, подвергаются полному необратимому гидролизу. В таблице растворимости для таких солей указывается прочерк.
карбонат алюминия
Al2(CO3)3 + 3H2O = 2Al(OH)3$ + 3CO2#
MgS +2H2O = Mg(OH)2$ + H2S#
Вопросы для самопроверки
10. Какие ионы обязательно присутствуют в растворе любой кислоты?
11. Какие ионы обязательно присутствуют в растворе любого основания?
12. Исходя из теории электролитической диссоциации, дайте определения понятиям кислота, основание, соль.
13. Перечислите свойства кислот
14. Перечислите свойства оснований
15. Каковы условия необратимости реакций ионного обмена?
16. Что такое гидролиз соли?
17. Какие соли подвергаются гидролизу?
Приложение
Таблица 1. Зависимость окраски индикатора от характера среды раствора
| Индикаторы | Цвет индикатора | ||
| в кислой среде | в нейтральной среде | в щелочной среде | |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Красный | Оранжевый | Желтый |
Таблица 2
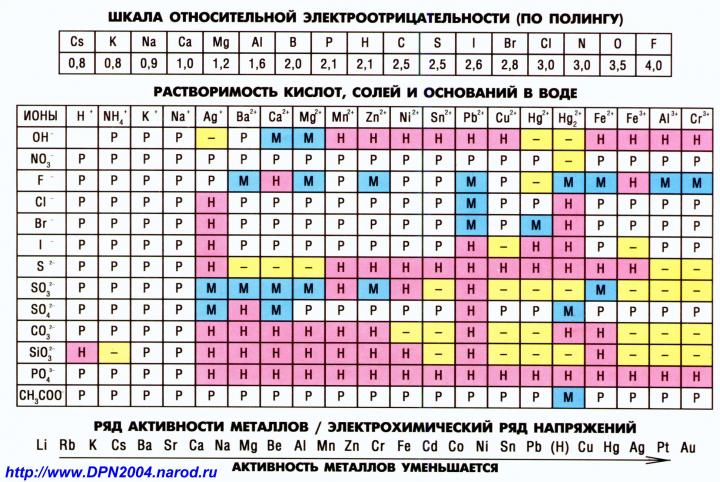

Урок 27.
