Лабораторная работа 4 Свойства кислот и оснований в свете теории электролитической диссоциации.
Цель работы
Осуществить реакции, подтверждающие химические свойства кислот и оснований и объяснить при помощи сокращенных ионных уравнений сущность этих реакций.
Пояснения к работе
Электролитической диссоциацией называют процесс распада электролитов на ионы в водных растворах или в расплавах. При диссоциации молекулы электролитов (кислот, солей, оснований) распадаются на положительно заряженные ионы, называемые катионами и отрицательно заряженные ионы, называемые анионами. Катионы и анионы в растворе химически связаны с молекулами воды – гидратированы, но для простоты написания уравнений электролитической диссоциации в них обычно гидратацию не показывают.
Кислоты.
Диссоциация кислот:
HCl 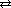 H+ + Cl-
H+ + Cl-
HNO3 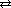 H+ + NO3-
H+ + NO3-
Диссоциация многоосновных кислот происходит ступенчато:
первая ступень H2S 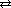 H+ + HS-
H+ + HS-
вторая ступень HS- 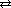 H+ + S2-
H+ + S2-
Из уравнений диссоциации видно, что общим для всех кислот является присутствие в растворе катионов водорода(H+).
Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода(H+).
Именно катионы водорода являются причиной общих свойств всех кислот: кислый вкус, изменение окраски индикаторов, взаимодействие с металлами, основными оксидами, основаниями.
Химические свойства кислот
1) Диссоциация
HCl = H+ + Cl-
2) Взаимодействие растворов кислот с металлами:
2HCl + Zn = ZnCl2 + H2#
2H+ + 2Cl- + Zn0 = Zn2+ + 2Cl- + H20#
2H+ + Zn0 = Zn2+ + H20#
3) Взаимодействие кислот с основными оксидами:
H2SO4 +MgO = MgSO4 + H2O
2H+ + SO42- +MgO = Mg2+ + SO42- + H2O
2H+ +MgO = Mg2+ + H2O
4) Взаимодействие кислот с основаниями (реакция нейтрализации):
HNO3 + NaOH = NaNO3 + H2O
H+ + NO3- +Na+ + OH- = Na+ + NO3- + H2O
H+ + OH- = H2O
Сокращенные ионные уравнения этих взаимодействий еще раз показывают, что именно катионы водорода (H+) участвуют в реакциях со стороны кислот.
Кислоты могут реагировать с солями, если образуется газ, осадок или слабый электролит (см. “Реакции ионного обмена”).
H2SO4 + K2CO3 = K2SO4 + CO2# + H2O
2Н+ + SO42- + 2K+ + CO32- = 2K+ + SO42- + CO2# + H2O
2Н+ + CO32- = CO2# + H2O
H2SO4 + Ва(NO3)2 = ВаSO4$ + 2HNO3
2Н+ + SO42- + Ba2+ + 2NO32- = BaSO4$ + 2H+ + 2NO32-
Ва2+ + SO42- = ВаSO4$
H2SO4 + 2NaF = Na2SO4 + 2HF
2Н+ + SO42- + 2Na+ +2F- = 2Na+ + SO42- + 2HF
Н+ + F- = HF
Основания.
Диссоциация оснований:
NaOH D Na+ + OH-
KOH D K+ + OH-
Диссоциация многокислотных оснований происходит ступенчато:
первая ступень Ba(OH)2 D BaOH+ + OH-
вторая ступень BaOH+ D Ba+ + OH-
Из уравнений диссоциации видно, что общим для всех оснований является присутствие в растворе гидроксид-ионов(OH-).
Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы(OH-).
Именно гидроксид-ионы являются причиной общих свойств всех оснований:
изменение окраски индикаторов (для растворимых оснований – щелочей), взаимодействие с кислотными оксидами, с кислотами, с растворами солей.
