Дослід № 3 Гідроліз солей.
Питання для самопідготовки.
1.Електронна структура біогенних s- , p- ,d- елементів.
2.Типові хімічні властивості елементів та їх сполук(К, Nа , Са, Мg, С, S ,N, Fе, Cu, Zn, Mn)
( реакції без зміни ступеня окислення, зі зміною ступеня окислення, комплексоутворенням)
3. Зв'язок між місцезнаходженням s- , p- ,d- елементів у періодичній системі та їх вмістом в організмі людини.
4.Написання окисно-відновних реакцій за допомогою електронного балансу.
Теоретичні відомості.
1. У періодичній системі хімічних елементів Д. І. Менделєєва біогенні s-елементи входять до головних підгруп І та II груп. Вони розміщені на початку періоду, є типовими металами.
s-Елементи характеризуються малими значеннями потенціалів іонізації при достатньо великих значеннях радіусів атомів та іонів. s -Елементи І групи, як правило, утворюють сполуки з іонним типом зв'язку, s -елементи II групи дещо поступаються їм щодо цього. Вказані особливості роблять їх фізіологічно активними. Деякі елементи, наприклад, К, Nа, Са, Мg,— життєво необхідні й виявляють в організмі унікальні властивості.
Більшість біогенних s -елементів є макроелементами. Їх висока концентрація в організмі пов'язана з утворенням сполук, що легко розчиняються в біологічних рідинах (s -елементи І групи), і важкорозчинних солей, які беруть участь у процесах формування кісткової тканини (s -елементи II групи). Біогенні елементи І групи потрібні для нормальної життєдіяльності живого організму. В першу чергу, це макроелементи — водень, калій і натрій .
Атом водню має найпростішу електронну структуру Іs 1, велику енергію іонізації, тому зв'язки його сполук навіть з найбільш електронегативними атомами здебільшого є ковалентними. Функції іона водню в живому організмі ближчі до функцій іонів лужних металів, ніж галогенів. Показники його електронегативності є близькими до атома вуглецю, тому в багатьох сполуках з ним водень утворює ковалентні зв'язки. В організмі людини в ковалентно зв'язаному стані він входить до складу сполук із вуглецем, азотом, сіркою й ін. Незначна частина водню перебуває у вигляді іона гідроксонію Н3О+, який відіграє важливу роль у підтриманні необхідної кислотно-лужної рівноваги для перебігу біохімічних реакцій. Іони гідроксонію здебільшого виконують найважливіші функції: вбивають мікроби, що потрапляють до шлунка з іжею, і беруть участь у гідролітичних реакціях як каталізатори.
Літій за своїми властивостями трохи відрізняється від інших лужних металів: він має малий розмір іона і найбільшу поляризуючу здатність, що спричиняє високу сольватацію іона. Сполуки літію характеризуються значною іонною складовою зв'язку. В живому організмі літій здатний заміщувати натрій і напилки. На цьому ґрунтується методика лікування солями натрію при отруєнні літієм. Літій постійно є в крові, органах і тканинах людини. Має виразну біологічну дію (А. О. Войнар). Подібність хімічних властивостей літію і натрію визначає їх однакову дію на перебіг ферментативних процесів. Здатність Літію заміщати іони натрію в солях сечової кислоти, тим саме утворюючи розчинні сполуки, використовують при лікуванні Подагри. Літій характеризується десенсибілізуючою дією, при невеликій концентрації здатний до інгібіруючої дії на фактори к зсідання крові. Тому його сполуки можуть застосовуватися для комплексної профілактики і терапії тромбозів.
Різна концентрація катіонів калію і натрію усередині й зовні нервової клітини й її аксона і більш легке проходження крізь мембрану іонів К+ і С1-, ніж Nа+, приводять до того, що у клітині виникає різниця потенціалів близько 60-90 мВ, при цьому внутрішня поверхня клітинної мембрани заряджується негативно стосовно зовнішньої. Утворюється Nа+ — К+-насос. Під час збудження відбуваються біохімічні процеси, які спричиняють зміни проникності клітинної мембрани. В результаті іони натрію проникають усередину клітини, викликають локальне гасіння негативного заряду і змінюють його на позитивний. Виникає так званий потенціал дії. Відновлення початкового потенціалу відбувається не в результаті зворотного переміщення іонів натрію, а за рахунок виходу з клітини еквівалентної кількості іонів калію. Причина зміни проникності мембрани і транспорту іонів проти градієнта концентрації остаточно не з'ясована, але прямо залежить від клітинного метаболізму.
До біогенних елементів II групи належать макроелементи магній і кальцій, які, за класифікацією А. І. Венчикова, входять до групи біотиків, що відіграють роль пластичного матеріалу, а також створюють фізико-хімічні умови для перебігу фізіологічних процесів, і мікроелементи берилій і стронцій; роль Інших мікро- і ультрамікроелементів II групи в організмі з'ясована недостатньо.
Магній і кальцій є життєво важливими елементами. Кальцій основний структурний елемент живих організмів; магній входить до складу великої кількості ферментів і є активатором багатьох біохімічних процесів. Кальцій має більший радіус іона і відповідно меншу енергію іонізації порівняно з магнієм, що визначає характер зв'язків у його сполуках . Атом кальцію більший за розмірами, ніж атом магнію, тому його здатність до утворення гідратів, а також розчинність його карбонатів і фосфатів у воді порівняно з магнієвими сполуками меншими. Карбонати і фосфати кальцію є основним матеріалом, який бере участь у формуванні кісткової та зубної тканин.
Головна підгрупа ІV групи представлена р-элементами: вуглецем, кремнієм, германієм, оловом і свинцем.
На зовнішньому електронному рівні атоми цих елементів містять 4 електрони, що мають конфігурацію s2р2 .
Таким чином, атоми можуть приєднувати по 4 електрони й утворювати восьми електрон- ну оболонку.
У нормальному стані елементи цієї підгрупи мають на зовнішньому рівні два р-електрони і виявляють валентність, рівну 2 . У збудженому стані s-електрон зовнішнього рівня переходить на вільний осередок р-підрівня того ж рівня і всі електрони зовнішнього рівня стають неспареними .
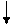 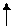 |  | 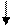 |
 | 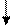 |  | 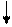 |
S Р S Р
12С 1s22s22р2 12С* 1s22s12р3
Виходячи з такої будови зовнішнього електронного рівня, найбільш характерними ступенями окислювання, що виявляються в з'єднаннях, для вуглецю і кремнію є -(+4; -4, для германія +4, для свинцю +2. Олово займає проміжне положення.
Енергія, затрачувана для переходу електрона, з надлишком компенсується енергією, що виділяється внаслідок утворення чотирьох зв'язків.
У процесі реакції р-елементи неметали можуть віддавати чи приймати електрони, тому вони беруть участь у метаболічних окисно-відновних реакціях. Окисно-відновні реакції, в яких беруть участь р-елементи, лежать в основі їх токсичної дії на організм. Наприклад, перехід нітратів у нітрити призводить до зниження перенесення кисню до тканин:
NО3 - +2Н + + 2е = NО2- + Н2О
Р-Елементи утворюють полідентатні хелатні сполуки з амінокислотами, поліпептидами, білками, нуклеїновими кислотами, вуглеводами тощо.
р-Елементи беруть участь у основних біохімічних процесах; утворюють білкові, фосфатні, бікарбонатні буферні системи; беруть участь у транспортуванні речовин і продуктів метаболізму.
З низькомолекулярних сполук р-елементів найбільше значення мають аніони: СО2-, НСО3 -, С2О42-, СН3СОО-, РО43-, НРО42-, Н2РО4-,
Для контролю за деякими оксоаніонами у біологічному матеріалі використовують якісні реакції:
• дія хлориду барію на сульфат-іони призводить до утворення білого осаду, який нерозчинний у кислотах:
SО42- + Ва2+ →ВаSО4 ↓;
• дія хлориду барію на сульфіт-іони призводить до утворення білого осаду, розчинного у кислотах. Для визначення SО32-, використовують реакцію знебарвлення розчину перманганату калію:
SО32- + Ва2+ →ВаSО3 ↓;
ВаSО3 + 2НСІ → SО2 ↑+ ВаС12 + Н2О;
• дія хлориду барію на карбонат-іони приводить до утворення білого осаду, розчинного у розведених мінеральних кислотах. СО2 виявляють за помутнінням баритової чи вапняної води:
СО2- + Ва+2 →ВаСО3↓,
ВаСО3 + 2НСІ → СО2↑ + ВаС12 + Н2О
СО2 + Са(ОН)2 → СаСО3↓ + Н2О;
• нітрит-іон за наявності сульфатної чи хлороводневої кислот окислює І- до вільного йоду, який забарвлює розчин у бурий колір. Йод дає синє забарвлення з крохмалем:
2І- + NО2- + 4Н+ → І2 + 2Н2О + 2 NО2↑
3. У періодичній системі d-елементи розташовані у великих періодах. За вертикаллю вони утворюють групи; у короткій формі періодичної системи це побічні підгрупи, а у довгоперіодному варіанті — ІВ -VШВ групи, тобто до номера групи додається буква В. Крім того, елементи d -блоку також називають елементами вставних декад чи перехідними металами.
У атомах d -елементів електронами заповнюється d -підрівень передостаннього рівня. Ємність d -підрівня дорівнює десяти.
Відомо більше ніж d -елементів, які в періодичній системі елементів утворюють три повні вставні декади (Sс — Zn, Y — Сd, Lа — Нg), та декілька елементів четвертої декади. Заповнення електронами d -підрівня відбувається відповідно до правила Гунда, тобто сумарне значення спинових чисел повинно бути максимальним.
На зовнішньому рівні атомів d елементів є один або два електрони s-стану (за винятком паладію, у якого s-електронів на зовнішньому рівні немає).
Зменшення кількості s-електронів на зовнішньому рівні до одного відбувається внаслідок «провалу» (або «проскоку») електрона з s-зовнішнього на передостанній d -підрівень, завдяки чому досягається більш стійкий стан із низьким запасом енергії. Наприклад, у атомах елементів хрому, молібдену, ніобію, срібла, золота й ін.
В атомах паладію s-електрони зовнішнього підрівня відсутні внаслідок подвійного «проскоку».
Для атомів перехідних металів характерними є два особливо стійких стани: у першому орбіталі передостаннього d - підрівня заповнені на 50 % , а в другому — d -орбіталі заповнені повністю .
Елементи, атоми яких мають від одного до п'яти d - електронів (у атомах цих елементів відсутня неподілена d-електронна пара), утворюють стійкі сполуки, в яких вони виявляють вищий позитивний ступінь окислення. За кількості електронів понад п'яти (деякі понад п'яти деякі d - електрони мають неподілену пару) найбільш стійкими є сполуки, в яких атоми d - елементів мають нижчий позитивний ступінь окислення, бо неподілена електронна пара не досить активно бере участь в утворенні хімічних зв'язків.
На стабільність d -елементів, атоми яких мають вищий ступінь окислення, вагомо впливає також збільшення маси атомів перехідних елементів. Це особливо виявляється при порівнянні властивостей оксидів К2О7, тобто оксидів марганцю, технецію і ренію, при нагріванні. Оксид марганцю (VII) не стійкий навіть при 0 °С і при нагріванні розкладається з вибухом.
Хід роботи
1. Записати електронні та графічні формули атомів: К,S, N, Cu, Fе.
_________________________________________________________________________________________________________________________________________________
Дослід № 1 Якісна реакція на иони натрію, калію, кальцію.
Взяти в шпатель солі Nа2SО4, К2SО4, СаSО4, та внести в полум’я горілки.
1.Як забарвлюють іони К+, Nа+, Са2+ полум’я?______________________________________
____________________
Дослід № 2 Якісна реакція на сульфат – іон.
В пробірку з розчином натрію сульфату додайте невелику кількість розчину барію хлориду.
1. Що ви спостерігаєте? Який осад якого кольору випав під час цієї реакції? Чому цю реакцію називають якісною? ____________________________________________________
__________________________________________
2.Напишіть рівняння взаємодії натрію сульфату з барієм хлоридом в повному і скороченому іонному вигляді.
_______________________________________
Дослід № 3 Якісна реакція на сульфіт – іон.
В пробірку наливають 5-6 крапель розчину сульфіту натрію та 5-6 крапель сульфатної кислоти, в верхню частину пробірки кладуть стрічку фільтрувального паперу змочену
Краплею розчину крохмалю і краплею розбавленого розчину йоду. Пробірку закривають пробкою з отвором , нагрівають та спостерігають зникнення синього забарвлення крохмалю.
1.Написати рівняння взаємодії сульфіту натрію з сульфатною кислотою. ____________
2. Який газ утворюється?_______________________________________________________
Дослід № 4 Якісна реакція на нітрат іон.
В пробірку з розчином калію нітрату чи натрію додати невеликий кусок міді, та прилити 1мл концентрованої сульфатної кислоти.
1. Що ви спостерігаєте? Який газ виділяється ?____________________________________ ____________
2. Напишіть відповідну реакцію. Розставте коефіцієнти методом електронного балансу.
_________________________________________
Дослід №5. Якісна реакція на карбонат – іон.
Налийте в пробірку розчин натрію карбонату. Додайте кілька крапель хлоридної кислоти. Внести підпалену скіпку в пробірку. 1. Що ви спостерігаєте? Який газ виділяється під час цієї реакції? Написати рівняння в повному і скороченому іонному вигляді. _________________________________________
2. Чому реакцію між карбонатами й кислотами називають якісною? ________________________________________________
Дослід №6. Якісні реакції йонів d-елементів ( Fе2+, Fе3+, Cu2+, Zn2+, Mn2+).
| Реагент | Катіони | ||||
| Fе2+ | Fе3+ | Cu2+ | Zn2+ | Mn2+ | |
| NаОН | Fе(ОН)2↓ | Fе(ОН)3↓ | Cu(ОН)2↓ | Zn(ОН)2↓ | Mn(ОН)2↓ |
| Колір осаду |
Таблиця 1. Реакції катіонів ( Fе2+, Fе3+, Cu2+, Zn2+, Mn2+).
Написати рівняння якісних реакцій:
1.___________
2.___________
3.___________
4.___________
5.___________
Висновок:_______________________________________________________________________________________________
Контрольні запитання:
1. Написати електронну та графічну формулу запропонованого елементу._______________
____________________
2. Написати рівняння реакцій типових хімічних властивостей запропонованих елементів та їх сполук.___________________________________________________________________
______________________________________________________________________________________________________________________________________________________________
3. Зв'язок між місцезнаходженням s- , p- ,d- елементів у періодичній системі та їх вмістом в організмі людини. _________________________________________
4.Розставити коефіцієнти методом електронного балансу:
Cu + HNO3( p) → Cu(NO3)2 + NO + H2O
___________________________________________________________________________________
Pb(NO3)2 → PbO + NO2 + O2 _______________________________________________________________________________
Cl2 + NaOH → NaClO + NaCl + H2O _______________________________________________________________
Домашнє завдання
 |
1. Записати електронні та графічні формули атомів: Nа, С1, Cа, Br.
__________________________________________________________________________________________
2.Розставити коефіцієнти методом електронного балансу:
SO2 + NaIO3 + H2O → NaI + H2SO4 ___________________________________________________________________________________
3.Яка сполука мангану широко застосовується в медицині та лабораторіях? За рахунок яких властивостей? Як поводить себе ця сполука , реагуючи з Nа2SО3 в середовищах з різним значенням рН?Написати відповідні реакції. Розставити коефіцієнти методом електронного балансу. __________________________________________________________________________________________________________________________
Практичне заняття № 2 Дата______________
Тема: Величини, які характеризують кількісний склад розчинів.
Мета: знати:теоретичні відомості про роль розчинів у життєдіяльності організмів, механізм процесів розчинення, розчинність речовин, залежність розчинності від температури, природи розчинних речовин та розчинника, способи вираження кількісного складу розчинів: масова частка розчиненої речовини, молярна концентрація , молярна концентрація еквівалента, титр. Сучасні уявлення про будову комплексних сполук. Класифікацію комплексних сполук за зарядом внутрішньої сфери та за природою лігандів. Номенклатуру комплексних сполук. Добування та властивості комплексних сполук
вміти: характеризувати кількісний склад розчинів: масова частка розчиненої речовини, молярна концентрація , молярна концентрація еквівалента, титр; вміти готувати розчини із заданим кількісним складом , складати формули та рівняння реакцій комплексоутворенням для розуміння ролі природних комплексних сполук у життєдіяльності організмів; пояснювати принципи будови комплексних сполук.
володіти навичками: робити розрахунки кількісного складу розчинів: масова частка розчиненої речовини, молярна концентрація , молярна концентрація еквівалента, титр; готування розчинив із заданим кількісним складом; складати формули та рівняння реакцій комплексоутворенням для розуміння ролі природних комплексних сполук у життєдіяльності організмів; пояснювати принципи будови комплексних сполук.
Обладнання та реактиви: терези,хімічний посуд:мірні циліндри,хімічні стакани, скляні палички, конічні колби, кухонна сіль. натрія карбонат, хлоридна кислота, купруму хлорид, натрію гідрооксид, сульфатна кислота, оцтова кислота, розчин амоніаку, лакмус, метиловий оранжевий , фенолфталеїн.
Питання для самопідготовки.
1. Що таке розчин?
2. Як поділяють розчини за агрегатним станом?
3. Що таке розчинник, розчинювана речовина?
4. Який процес називається розчиненням? Поясніть суть процесу розчинення.
5. Який розчин називається насиченим? Ненасиченим?
6. Які речовини вважають добре розчинними, малорозчинними, практично нерозчинними?
7. Як впливають температура і тиск на розчинність твердих, рідких та газоподібних речовин?
8. Яке значення мають розчини в житті людей?
9.Які ви знаєте способи вираження складу розчинів?
Дати визначення комплексних сполук.
10.Мати уявлення про поняття : комплексний іон, ліганд, комплексоутворювач, координаційне число, внутрішню та зовнішню координаційну сферу.
11. Класифікація комплексних сполук.
12.Значення та роль комплексних сполук у життєдіяльності організмів.
13.Номенклатура комплексних сполук. 14.Добування комплексних сполук. Їх властивості.
Хід роботи
1. Розв’язання розрахункових задач, пов’язаних з приготуванням розчинів різної концентрації._____________________________________________________________________________________________________________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________
1.Розрахувати заряди наступних комплексних іонів, утворених хромом з ступенем окислення +3
[Cr(Н2О)5С1], [Cr(Н2О)4С12], [Cr(Н2О)2 (С2О4)2].
2. Назвати комплексоутворювач, його заряд, координаційне число в комплексних сполуках:
К4[РtС16] ____
Nа3[А1(ОН)6]_________________________________________________________________
Nа2[Sn(ОН)4]_________________________________________________________________
[Сг(Н2О)6]Вг3 ________________________________________________________________ [Рt(NH3)3С1]С1_______________________________________________________________
[Сu(NН3)4] SO4_______________________________________________________________
3. Назвати комплексні сполуки:
[Со(Н2О)6]С12 _______________________________________________________________ К3[Со(NO2)6]; ________________________________________________________________
К3[А1(ОН)6];_________________________________________________________________
Na3[Cr(CN)6]_________________________________________________________________
4.Написати формулу комплексної сполуки, яка має назву:
а) хлорид хлоротриамінплатина (ІІ)_______________________________________________
б) сульфат бромпентаамінкобальт(ІІІ)_____________________________________________
в) тетрароданодиамінхромат (ІІІ) барію____________________________________________
г) тетрахлородигідроксоплатинат (ІV)калію ________________________________________
5. Написати в молекулярній та іонно-молекулярній формі рівняння обмінних реакцій які відбуваються між:
а) К4[Fе(СN)6] і СuSO4; б) Na3[Co(CN)6] і FeSO4 ; в) К3 [Fе(СN)6] і AgNO3, маючи на увазі, що утворені комплексні солі нерозчинні у воді.
а)___________________________________
б)___________________________________
в)___________________________________
Дослід № 1Якісні реакції на катіони феруму Fe3+ та Fe2+ .
а) Реакція з гексаціанофератом (ІІІ) калію К3[Fе(СN)6] ( червоною кров’яною сіллю).
В пробірку додати 2-3 краплі розчину солі феруму (ІІ)хлориду та 1-2 краплі розчину червоної кров’яної солі.
1. Що спостерігаєте? Якого кольору осад? _______________________________________
__________________________________________
2. Напишіть рівняння реакції в повному та скороченому іонному вигляді.
____________________
3.Чому реакцію між гексаціанофератом (ІІІ) калію та солями феруму (ІІ) називають якісною? ___________________________________________________________________________________
б) Реакція з гексаціанофератом (ІІ) калію К4 [Fе(СN)6] ( жовтою кров’яною сіллю).
В пробірку додати 2-3 краплі розчину солі феруму (ІІІ)хлориду та 1-2 краплі розчину жовтої кров’яної солі.
1. Що спостерігаєте? Якого кольору осад?_________________________________________ __________________________________________
2. Напишіть рівняння реакції в повному та скороченому іонному вигляді.
___________________________________________________________________________________
3.Чому реакцію між гексаціанофератом (ІІ) калію та солями феруму (ІІІ) називають якісною? ____________________
Висновок:__________________________________________________________________________
1. Назвати комплексоутворювач, його заряд, координаційне число в комплексних сполуках:
К[Pt(NH3)Cl5]_________________________________________________________________
Li[Co(CN)4H2O]_______________________________________________________________
Cu2[Fe(CN)6]_________________________________________________________________
К3[Co(NO2)6]_________________________________________________________________
2. На які йони дисоціюють комплексні та подвійні солі?
Na3[Co(NO2)6] ↔ ___________________________________________________________
K[AuCl4] ↔________________________________________________________________ [Cr(H2O)6]Cl2 ↔____________________________________________________________
KCr(SO4)2 ↔______________________________________________________________
CuCl2 · 2KCl ↔_____________________________________________________________
3. Написати в молекулярній та іонно-молекулярній формі рівняння обмінних реакцій які відбуваються між: [Ag(NH3)2]Cl та НNО3.
____________________
4. Написати формулу комплексної сполуки, яка має назву:
1. Диамінотетрацианокобальтат(ІІ) натрію_______________________________________
2. Триакватрифторохром ___________________________________________________
3. Хлорид тетраамінодифтороплатини(ІV) _____________________________________
4. Хлорид диамінсрібла(І) _____________________________________________________
Домашнє завдання
 |
1.Для підтримання життєдіяльності препаратів у фізіології використовують розчин Рінгера для жаби, який готують так: на 100 см3 дистильованої води беруть натрій гідрогенкарбонат ( NаНСО3 ) масою 0,012 г. Визначити масову частку ( % ) NаНСО3 у приготовленому розчині? ____________________________________________________________________________________________________________________________________________________________________________________
2. Змішали 300г розчину амоній нітрату з масовою часткою NН4NО3 20% та 500г розчину з масовою часткою NН4NО3 40% . Розрахувати масову частку NН4NО3 в отриманому розчині._______________________________________________________________________________________________
Практичне заняття № 3 Дата__________
Тема: Водневий показник. Гідроліз солей. Мета: знати: Механізм буферної дії. Приготування буферних розчинів та обчислення рН середовища. Водневий показник (рН) як кількісна міра активної кислотності та основності. Дисоціацію води. гідроліз солей, ступінь гідролізу, залежність його від концентрації та температури. Константа гідролізу. Зміщення рівноваги гідролізу. Значення гідролізу в життєдіяльності організмів.
вміти: експериментально визначати рН буферних розчинів, вміти пояснювати механізм буферної дії; визначати співвідношення компонентів гідрокарбонатної, фосфатної буферних систем, при якому рН буферної системи дорівнює рН крові; визначати зміну рН буферних розчинів при додаванні до них невеликих кількостей розчинів сильних кислот або лугів; проводити розрахунки рН середовища, робити висновки щодо кислотності біологічних рідин на підставі водневого показника; вміти експериментально визначати рН; вміти складати молекулярні та йонні рівняння реакцій гідролізу, погнозувати зміщення рівноваги гідролізу.
володіти навичками: експериментально визначати рН буферного розчину; визначати співвідношення компонентів гідрокарбонатної, фосфатної буферних систем, при якому рН буферної системи дорівнює рН крові; визначати зміну рН буферних розчинів при додаванні до них невеликих кількостей розчинів сильних кислот або лугів, експериментально визначати рН; складати молекулярні та йонні рівняння реакцій гідролізу, погнозувати зміщення рівноваги гідролізу.
Обладнання та реактиви: сульфатна кислота, оцтова кислота, розчин амоніаку, лакмусовий папір, метиловий оранжевий , фенолфталеїн, натрію карбонат, алюмінію хлорид, калію хлорид, ацетат натрію.
Питання для самопідготовки.
1.Які розчини називають буферними? 2.Наведіть приклади буферних сумішей.
3.Як впливає на величину рН буферної суміші, щоскладається з оцтової кислоти та її натрієвої солі, невелика кількість сильної кислоти?
4.Як впливає на величину рН буферної суміші, що складається з гідроксиду амонію та хлориду амонію, невелика кількість лугу? 5.Чому розведення водою буферної суміші не змінює рН розчину? 6.Наведіть приклади застосування буферних сумішей. 7.Поясніть механізм дії і види буферних розчинів. Сформулюйте , що таке електролітична дисоціація. Яка роль води при дисоціації?
8.Дайте визначення кислот і основ з точки зору електролітичної дисоціації? Приведіть приклади. 9.Що таке ступінь електролітичної дисоціації? 10.Навести приклади сильних і слабких електролітів. 11.В чому суть реакції іонного обміну? Дайте визначення. 12.За яких умов реакції іонного обміну проходять до кінця? 13.Дати визначення йонному добутку води. 14. Водневий показник. 15.Обчисліть еквівалентні маси речовин, формули яких такі: Н3РО4, Ва(ОН)2, А12(SО4)3, Сu(NO3)2, КNО3, NаС1, Fе(ОН)3, Н4Р2О7.
16..Дати визначення гідролізу солей.
17.Що показує показник рН? Яке значення він має у кислому, нейтральному та лужному середовищах?
18. Серед перелічених нижче солей вкажіть ті, які підлягають гідролізу: KNO3, Cr2(SO4)3, AlI3, CaCl2, K2SiO3.
19.Від яких факторів посилюється гідроліз солей?
20.Чи відносять гідроліз до необоротних процесів? 21.За яким ступенем гідроліз практично не відбувається?
Хід роботи
Дослід № 1 Визначення реакції середовища за допомогою індикаторів. Наливають у три пробірки небагато розведеного розчину якої-небудь кислоти, в інші три - дистильовані води і ще в три - розведені розчини лугу. Пробірки розподіляють на три серії (кислота, вода, луг) і додають у кожну по трохи капель розчинів індикаторів: у першу серію - лакмусу, у другу - метилового жовтогарячого й у третю - фенолфталеїну. Уміст пробірок розмішують скляною паличкою. Фарбування індикаторів, що спостерігається, записують у виді таблиці за формою:
| Індикатор | Колір | |||
| кисле середов. рН < 7 | нейтральне середов. рН = 7 | лужне середов рН > 7 | Інтервали рН | |
| Лакмус Метиловий оранжевий Фенолфталеїн |
Дослід № 2. Визначення рН розчину. Універсальним індикатором.
У три пробірки наливають по 2-3 мл 0,1 н. розчинів: в одну - соляної кислоти, в іншу - оцтової кислоти, у третю - аміаку, у четверту - водопровідної води. Додають у кожну пробірку 1-3 краплі універсального індикатора. Збовтують. Фарбування порівнюють з кольором еталонних розчинів, що містять той же індикатор . При збігу фарбування еталонного розчину з фарбуванням випробуваного розчину судять про величину рН останнього. Результати записують у виді таблиці за формою:
| Досліджуваний розчин | Колір індикатора | Значення рН |
| 1. Хлоридна кислота 2. Оцтова кислота 3. Амоніак 4. Водопровідна вода |
Дослід № 3 Гідроліз солей.
В 4 пробірки прилийте 5 крапель розчину лакмусу. Потім в 1-у пробірку добавте 5 крапель розчину натрію карбонату, в 2-у стільки ж алюмінію хлориду, в 3-ю калію хлориду, в 4-у дистильованої води.
1.Порівняйте забарвлення лакмусу в перших трьох пробірках з 4ю. ________________________________________
2. Скласти рівняння гідролізу по першій стадії. В молекулярній та іонній формах, якщо він має місце. ________________________________________________________________________________
3. Зробіть висновок, чи залежить процес гідролізу солі від природи утворюючих її катіонів та аніонів. ____________________
