Дослід 2. Вплив розбавлення розчину на гідроліз солі
А. У пробірку наливають 1 мл концентрованого розчину нітрату
бісмуту – Bi(NO3)3 і розбавляють в 4-5 разів дистильованою водою. Спостерігають випадіння осаду. Додають1-2 мл нітратної кислоти. Що сталося з осадом?
Б. У пробірку наливають 1 мл розчину хлориду стибію – SbCl3 і в 2-3 рази розбавляють дистильованою водою. До одержаного осаду додають краплями хлорогідрогенну кислоту до повного його розчинення. Додають воду до утворення осаду. Записують рівняння реакцій у молекулярній та іонній формах.
Дослід 3. Вплив температури на гідроліз
У пробірку наливають 3 мл розчину ацетату барію – (CH3COO)2Ba і додають кілька крапель фенолфталеїну. Вміст пробірки нагрівають до кипіння, спостерігають зміну кольору індикатора і роблять висновок про вплив нагрівання на гідроліз солі. Складають молекулярні та іонні рівняння реакцій гідролізу цієї солі.
Який висновок можна зробити про зміну концентрації іонів ОН - в розчині на підставі зміни забарвлення фенолфталеїну при нагріванні?
МЕТОДИЧНІ ПОРАДИ
Хімічно чиста вода є дуже слабким електролітом. Вона незначною мірою дисоціює на іони за рівнянням:
2Н2 O  Н3О+ + ОН -, або у спрощеному вигляді:
Н3О+ + ОН -, або у спрощеному вигляді:
Н2O  Н + + ОН -.
Н + + ОН -.
Залежно від концентрації іонів Н + або ОН - реакцію середовища розчинів (тобто їх кислотність або лужність) виражають так:
• якщо у розчині [Н+] = [ОН -] = 10 -7 моль/л - середовище нейтральне;
• якщо [Н+] >[ОН-]; [Н +] > 10 -7 моль/л - середовище кисле;
• якщо [Н +]<[ОН -]; [Н +]<10 -7 моль/л - середовище лужне.
На практиці записувати концентрації іонів Н+ або ОН- через від'ємний ступінь не зовсім зручно. Тому кислотні властивості розчинів характеризують величиною водневого показника рН.
Водневий показник рН - це від'ємний десятковий логарифм концентрації іонів гідрогену в розчині.
рН = - lg [Н +], або [Н +] = 10 -рН.
Оскільки концентрація іонів гідрогену може змінюватись у межах іонного добутку, то рН змінюється в інтервалі від нуля до чотирнадцяти. За допомогою рН середовище розчинів характеризується так:
• нейтральне - рН = 7 (рН = - lg 10 -7=7);
• кисле - рН < 7;
• лужне - рН>7.
Наочно взаємозв'язок між концентрацією іонів гідрогену, величиною рН і реакцією середовища розчину можна виразити схемою:
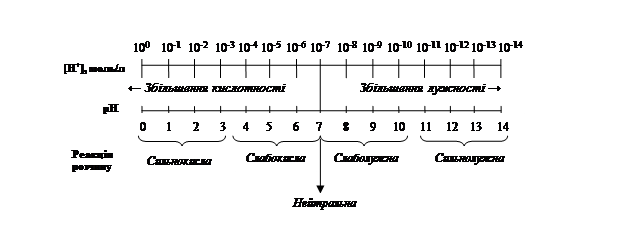
Із схеми видно, що чим менше значення рН розчину, тим більша концентрація іонів Н+, тобто вища кислотність середовища; і навпаки, чим більше значення рН, тим менша концентраціяі іонів Н+, тобто вища основність середовища.
Наприклад, значення рН дощової води складає 6 (слабокисла реакція); водопровідної води – рН = 7,5 (слаболужна реакція).
