Термодинамические процессы
В РЕАЛЬНОМ ГАЗЕ
При исследовании термодинамического процесса требуется определить значения всех параметров рабочего тела в начале и конце процесса, а также вычислить работу, совершенную телом, и подведенную к нему (либо отведенную) теплоту. Для этого необходимо знать уравнение процесса в какой-либо системе координат, уравнение состояния рабочего тела и уравнение для расчета внутренней энергии. Также должны быть заданы параметры, определяющие начальное состояние рабочего тела (например, Т и р для перегретого пара, р и х для влажного пара), и один из изменяющихся в процессе параметров в конечном состоянии (либо величина, по которой его можно рассчитать). Выбор тех или иных исходных данных обусловлен характером процесса либо решаемой задачей. Например, могут быть заданы параметры рабочего тела в одном из указанных состояний и значение теплоты либо работы процесса, а требуется определить параметры в другом состоянии.
Для воды и водяного пара и для многих хладагентов имеющиеся таблицы и диаграммы полностью заменяют уравнение состояния и уравнение для внутренней энергии и позволяют рассчитывать термодинамические процессы. При решении задач применение аналитического либо графического метода в конкретных случаях определяется видом процесса и требуемой точностью расчета. В принципе, все термодинамические задачи можно решить с помощью таблиц, однако тогда приходится много интерполировать. Поэтому иногда сочетают оба метода: часть свойств определяют по таблицам, а часть — по диаграммам.
Существенной особенностью процессов в любом реальном газе является возможность их протекания как в однофазной, так и в двухфазной области или последовательно в обеих фазах. Поэтому всегда необходимо определять с помощью таблиц либо диаграмм, к какой из этих областей относятся начальное и конечное состояния рабочего тела. Это обстоятельство определяет использование тех либо иных таблиц и, при необходимости, формул для расчета свойств влажного пара.

 При расчетах процессов могут встретиться следующие случаи:
При расчетах процессов могут встретиться следующие случаи:
1. Начальное и конечное состояния относятся к однофазной области, причем процесс может либо полностью протекать в этой области, либо проходить также через двухфазную область. В этом случае задача решается с помощью таблиц для жидкости и перегретого пара.
2. Начальная и конечная точки лежат в двухфазной области. В такой ситуации используют таблицы для кривой насыщения и формулы для расчета свойств влажного пара.
3. Процесс начинается в однофазной, а заканчивается в двухфазной области (либо наоборот). В данном случае термодинамические свойства в точке, относящейся к однофазной области, определяют по таблице свойств жидкости и перегретого пара, а свойства во второй точке рассчитывают по формулам для свойств влажного пара с использованием таблиц для состояния насыщения.
Во всех случаях задачи можно решать с помощью диаграмм, но следует иметь в виду, что на диаграмме h,s для водяного пара отсутствуют пограничная кривая насыщенной жидкости и область жидкости.
Ниже рассматриваются процессы, протекающие при постоянных значениях термических параметров (изобарный, изохорный и изотермический), а затем более сложные процессы, совершающиеся при постоянных значениях калорических свойств (адиабатный (изоэнтропный) и процесс дросселирования). В заключение главы подробно рассмотрен весьма важный для паротурбинных установок процесс течения пара.
2.1. Изобарный процесс
Данный процесс весьма распространен на практике и имеет место в большинстве теплообменных аппаратов. В частности, процесс нагрева жидкости до температуры кипения, парообразования и перегрева пара в котельном агрегате протекает при постоянном давлении.
Для изобарного процесса деформационная работа (работа расширения) рассчитывается по формуле
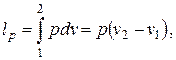 | (2.1) |
а техническая работа равна нулю (поскольку при p = const dp=0)
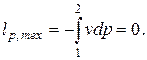 | (2.2) |
Из второй формы основного уравнения термодинамики
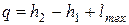 | (2.3) |
следует, что в изобарном процессе теплота qp равна изменению энтальпии (так как lp,тех=0). Изменение внутренней энергии ∆и=и2—и1определяется из первой формы основного уравнения термодинамики.
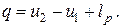 | (2.4) |
Приведенные формулы справедливы независимо от области протекания процесса. Если в процессе участвуют М кг вещества, в формулах появляется множитель М.
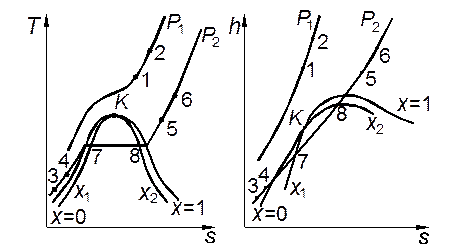 Рис. 2.1. Изобарный процесс в реальном газе на диаграммах T,s и h,s. Рис. 2.1. Изобарный процесс в реальном газе на диаграммах T,s и h,s. |
На рис. 2.1. изображены три отмеченных выше случая протекания изобарного процесса. В первом случае, когда начало и конец процесса относятся к однофазной области (например, в процессах 1–2, 3–4, 5–6, 3–6), следует задать давление р, начальную и конечную температуры Т1и Т2. Тогда по таблице для однофазной области (либо по диаграммам) находят значения v1, h1, v2, h2и рассчитывают значения энергетических эффектов (l, q и Δu) по соотношениям (2.1), (2.3) и (2.4).
Во втором случае, когда процесс полностью протекает в двухфазной области (например, процесс 7–8), задают давление р и значения степени сухости в начале и в конце процесса х1и х2. Значения v1, v2, h1 и h2 рассчитывают по формулам (1.22) и (1.23), причем значения v', v", h' и h" при заданном р берут из таблицы для состояния насыщения. Значения l, q и Δu рассчитывают так же, как и в предыдущем случае.
Если процесс частично протекает в однофазной и частично в двухфазной области (процесс 4–7), для состояния, относящегося к однофазной области, помимо давления задают температуру, а для влажного пара — значение х. Значения v и h для первого состояния определяют по таблице, a для второго — по формулам (1.22) и (1.23). Затем рассчитывают значения l, q и ∆и.
Могут встретиться и более сложные случаи задания параметров, когда вместо температуры либо степени сухости задано значение v, h либо s. Тогда состояние, в котором находится вещество, определяется путём сравнения заданного значения свойства с его значениями в состоянии насыщения. Если состояние относится к однофазной области, то значения других свойств находят по соответствующей таблице линейной интерполяцией, если же к двухфазной, то вначале определяют степень сухости х,а затем рассчитывают значения других свойств по формулам для влажного пара. Определив значения термических и калорических свойств в начале и в конце процесса, рассчитывают l, q и ∆u.
2.2. Изохорный процесс
Этот процесс протекает при нагреве (охлаждении) газа в баллонах. Близок к изохорному процесс сжатия жидкости в насосах (например, воды при подаче её в котёл) ввиду малой сжимаемости жидкости.
Независимо от области, в которой протекает этот процесс, его деформационная работа равна нулю (так как при v = const dv=0)
 | (2.5) |
а техническая работа рассчитывается по формуле
 | (2.6) |
Из первой формы основного уравнения термодинамики (2.4) следует, что в изохорном процессе теплота qv равна изменению внутренней энергии (поскольку lv=0).
При расчетах могут встретиться такие же случаи (рис. 2.2), как и рассмотренные выше при анализе изобарного процесса.
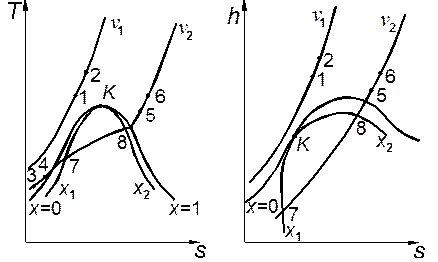 Рис. 2.2. Изохорный процесс в реальном газе на диаграммах T,s и h,s. Рис. 2.2. Изохорный процесс в реальном газе на диаграммах T,s и h,s. |
1. Если начальная и конечная точки процесса относятся к однофазной области (например, процессы 1–2, 3–4, 5–6 и 3–6), то помимо значения v следует задать значения давления либо температуры в этих точках. По указанным данным с помощью таблицы определяют интерполяцией значения третьего термического параметра и калорических свойств в начале и конце процесса. Затем рассчитывают значения внутренней энергии u1=h1– p1v и u2=h2– p2v и теплоты процесса qv=u2–и1.
2. В том случае, когда процесс протекает только в двухфазной области (например, процесс 7–8), начальное и конечное состояния могут быть заданы так же, как и в предыдущем случае. Тогда по значениям p1 и р2(либо Т1 и Т2) с помощью таблицы для состояния насыщения находят значения v1', v1", h1', h1" и v2', v2", h2', h2". Используя заданное значение v, рассчитывают х1 и х2 из соотношения (1.22), а затем значения h1 и h2 по формуле (1.23). Располагая значениями р, v и h в начальном и конечном состояниях, можно определить u1, и2и qv.
Иногда могут быть заданы значения v, x1и x2. Тогда определяют приближенные значения удельного объёма насыщенного пара v1" = v/x1и v2" = v/x2и по таблице для состояния насыщения находят соответствующие значения Т1, Т2либо р1, р2. Затем на основании формулы (1.22) уточняют значения температуры либо давления насыщенного пара методом последовательных приближений до приемлемого согласования заданного и расчетного значений v, после чего рассчитывают значения h1, h2, u1, и2и qv. С помощью диаграмм такая задача решается без приближений, но на диаграмме h,s большая часть двухфазной области не представлена.
3. Если процесс протекает частично в однофазной, а частично в двухфазной области (например, процессы 4–7, 5–8), для начального и конечного состояний помимо величины v должны быть заданы значения температуры (либо давления). Для влажного пара можно задать значения v и х. Тогда определяют энтальпиюв этих состояниях с помощью соответствующих таблиц, а затем рассчитывают значения u1, и2и qv.
Когда заданное значение температуры либо давления меньше критического, для определения области состояний, к которой относится точка, следует сравнить значение v с величинами v' и v", найденными по таблице для кривой насыщения. Если v<v', точка относится к области жидкости, если v'<v<v" — к двухфазной области, при v>v" — к области перегретого пара.
2.3. Изотермический процесс
Этот процесс с реальным газом в однофазной области встречается редко, но в двухфазной области изобарные процессы парообразования и конденсации одновременно являются изотермическими.
Количество теплоты, подведенной к 1 кг вещества в изотермическом процессе, рассчитывают по формуле
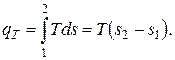 | (2.7) |
Деформационную и техническую работу изотермического процесса можно рассчитать по выражениям, полученным из основного уравнения термодинамики:
 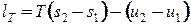 , , | (2.8) |
 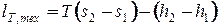 . . | (2.9) |
Следует подчеркнуть, что для реального газа, в отличие от идеального, значения разностей u2 – u1 и h2 – h1 на изотерме не равны нулю.
При расчетах могут встретиться те же случаи, что и при рассмотрении изобарного и изохорного процессов (рис. 2.3).
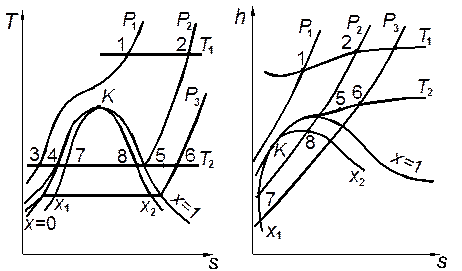 Рис. 2.3. Процесс T = const в реальном газе на диаграммах T,s и h,s. Рис. 2.3. Процесс T = const в реальном газе на диаграммах T,s и h,s. |
1. Начало и конец процесса расположены в однофазной области (например, процессы 1–2, 3–4, 5–6, 3–6). В этом случае помимо температуры обычно задают начальное и конечное давления р1и p2.Тогда по таблице находят значения v1, h1, s1 и v2, h2, s2, рассчитывают величины u1 и u2, а затем вычисляют qТ, lT и lT,тех по формулам (2.7) – (2.9). Если вместо одного либо обоих значений давления заданы значения удельного объёма, остальные свойства определяют по таблице интерполяцией.
2. Процесс протекает в двухфазной области (процесс 7–8). В этом случае изотермический процесс совпадает с рассмотренным выше изобарным процессом.
3.Процесс начинается в однофазной, а заканчивается в двухфазной области — процесс 4–7 (либо наоборот — процесс 8–5). Тогда для состояния, относящегося к однофазной области, помимо температуры задают давление, а для влажного пара — значение х. Значения v и h для однофазного состояния определяют по соответствующей таблице, а для двухфазного рассчитывают по формулам (1.22) и (1.23), определив предварительно значения свойств пара и жидкости на пограничной кривой по таблице для состояния насыщения.
При расчетах изотермического процесса, так же как изобарного и изохорного, можно использовать диаграммы Т,s и h,s (исключительно либо в сочетании с таблицами).
2.4. Изоэнтропный процесс
Этот процесс всегда встречается при тепловых расчетах циклов энергетических и холодильных установок, так как является идеальным (образцовым) процессом расширения водяного пара в турбине или сжатия хладагента в компрессоре холодильной установки.
Уравнение изоэнтропного процесса имеет вид s = сonst, отсюда следует, что он протекает без теплообмена между системой и окружающей средой, то есть является адиабатным. Действительно, поскольку ds = 0, теплота процесса также равна нулю
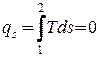 . . | (2.10) |
Из основного уравнения термодинамики в первой (2.4) и второй (2.3) формах при q = 0получаем
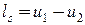 , , | (2.11) |
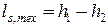 . . | (2.12) |
Итак, деформационная работа изоэнтропного процесса равна разности значений внутренней энергии, а техническая — разности значений энтальпии в начальном и конечном состояниях.
Расчеты изоэнтропного процесса легче проводить с помощью энтропийных диаграмм h,s либо Т,s. При этом, как и для других процессов, могут встретиться следующие частные случаи (рис. 2.4):
1. Процесс полностью протекает в однофазной области (процесс 1–2). Тогда для начальной точки задают обычно температуру Т1 и давление p1, а для конечной — давление р2. Определив на диаграмме точку пересечения изотермы Т1и изобары р1,находят значения v1, h1 и s1. Из этой точки проводят изоэнтропу до пересечения с изобарой р2и, определив конечное состояние, находят значения v2и h2. Затем определяют техническую работу по формуле (2.12) и деформационную — по формуле (2.11), рассчитав предварительно значения u1и u2.
При решении этой задачи с помощью таблиц определяют по таблице для однофазной области значения v1, h1 и s1. Если s1>s2" (где s2" —
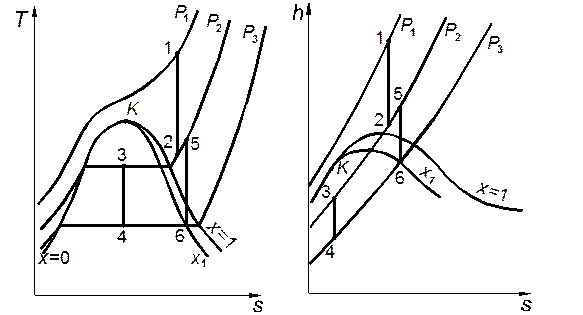 Рис. 2.4. Процесс s = const в реальном газе на диаграммах T,s и h,s. Рис. 2.4. Процесс s = const в реальном газе на диаграммах T,s и h,s. |
значение энтропии насыщенного пара при давлении р2),то пар в конечном состоянии перегрет. Тогда по этой же таблице на изобаре р2линейной интерполяцией находят точку, в которой s2=s1, и определяют значения v2и h2в этой точке. Деформационную и техническую работу определяют так же, как и при расчетах по диаграмме.
2. Процесс полностью протекает в двухфазной области (процесс 3-4). В этом случае задают давление р1(либо температуру Т1) и степень сухости х1в начале процесса (вместо х1 можно задать любое из аддитивных свойств — v1, h1 либо s1). Также задают давление в конце процесса р2.Определив начальную точку на пересечении соответствующих кривых, находят значения неизвестных свойств в начальном состоянии, затем проводят из нее изоэнтропу до пересечения с изобарой р2и находят свойства в конечном состоянии. После этого можно рассчитать деформационную и техническую работу по формулам (2.11) и (2.12).
Решая эту задачу с помощью таблиц, вначале определяют значения v’, v", h', h", s' и s" при давлении р1(либо при температуре Т1) по таблицам для кривой насыщения. Зная значение х1,по формулам (1.22)–(1.24) рассчитывают значения v1, h1и s1. Если вместо х1задано одно из этих свойств, то сначала определяют х1 по соответствующей формуле, а затем рассчитывают другие свойства. Поскольку в этом процессе s2=s1, определив по таблице значения s2' и s2" при давлении р2, рассчитывают степень сухости х2в конце процесса. Рассчитав затем значения v2и h2,получают все данные, необходимые для расчета l и lтех.
3. Если начальная точка процесса расположена в однофазной области, а конечная — в двухфазной (процесс 5–6), значения свойств в начальном состоянии определяют так же, как в первом случае, а в конечном — так же, как во втором.
В процессе изоэнтропного расширения давление пара понижается, поэтому если начальная точка процесса находится в однофазной области, то конечная может попасть в двухфазную. Если же начало процесса расширения находится в двухфазной области, то он весь расположен в ней. При изоэнтропном сжатии давление пара растёт, поэтому наблюдается обратная картина: процесс, начавшийся в однофазной области, полностью расположен там, а начавшийся в двухфазной области может закончиться в однофазной.
2.5. Процесс дросселирования
Дросселированием называется термодинамический процесс неравновесного перетекания газа либо жидкости от большего давления к меньшему без совершения работы. Дросселирование, протекающее без теплообмена с окружающей средой, называется адиабатным. Этот процесс происходит при большом местном сопротивлении, когда можно пренебречь изменением кинетической энергии. Из основного уравнения термодинамики для потока
 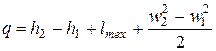 | (2.13) |
видно, что при адиабатном дросселировании h1=h2,то есть начало и конец процесса находятся на линии h = const (на изоэнтальпе).
Из второго закона термодинамики следует, что во всяком необратимом процессе энтропия возрастает. Так как дросселирование является явно необратимым процессом, то на энтропийных диаграммах конечная точка процесса всегда лежит правее начальной (рис.2.5). Заметим, что этот процесс изображают на диаграммах штриховой линией, подчеркивая его необратимость.
Во всех случаях, когда процесс начинается правее максимума линии h = const на диаграмме Т,s либо правее минимума изотермы на диаграмме h,s (процесс 1–2) температура вещества при дросселировании понижается (дроссельный эффект ah=(∂T/∂p)h положителен). Если же процесс начинается и оканчивается левее экстремумов этих линий (процесс 3–4), температура вещества повышается (дроссельный эффект отрицателен). Как отмечено в §1.3, кривая, соединяющая упомянутые экстремумы и разделяющая области параметров, в которых дроссельный эффект имеет разные знаки, называется кривой инверсии; на самой кривой ah=0. Если процесс начинается в области ah<0, а оканчивается в об-
 Рис. 2.5. Процесс дросселирования реального газа на диаграммах T,s и h,s. Рис. 2.5. Процесс дросселирования реального газа на диаграммах T,s и h,s. |
ласти ah>0 (например, процесс 5–6), то в итоге может наблюдаться как понижение, так и повышение температуры по сравнению с первоначальной в зависимости от соотношения протяженности участков процесса в соответствующих областях.
Для водяного пара в области параметров, охваченной диаграммой h,s (до 800 °С и100 МПа), дроссельный эффект положителен.В области жидкости при температуре ниже 200°С дросселирование воды сопровождается повышением температуры, и лишь при продолжении процесса в двухфазной области температура понижается.
В процессе дросселирования удельный объём реального газа во всех случаях увеличивается. При дросселировании влажного пара его степень сухости чаще всего возрастает, но если начальная точка процесса расположена на диаграмме h,s левее максимума соответствующей линии х = const, возможно некоторое уменьшение степени сухости.
Рассматриваемый процесс играет особую роль в холодильной технике. При дросселировании холодильного агента его температура понижается. Он поступает в испаритель при температуре, которая ниже температуры воздуха и продуктов, находящихся в охлаждаемом помещении. В испарителе влажный пар хладагента превращается в насыщенный пар, отбирая при этом теплоту от охлаждаемого объекта.
Задачи, связанные с определением параметров пара после дросселирования, решают с помощью таблиц термодинамических свойств либо диаграмм h,s и Т,s. При этом должно быть задано начальное состояние пара (значения р1, T1 либо р1, х1) и конечное давление р2.
Решая задачи с помощью таблиц, по начальным параметрам определяют значение энтальпии h1= h2 и сравнивают его со значением энтальпии насыщенного пара h2" при давлении р2. Если h2<h2", то пар после дросселирования влажный. Тогда по формуле (1.23) определяют значение х2, после чего, используя таблицу для кривой насыщения, можно рассчитать значения v2и s2по формулам (1.22) и (1.24). Если же h2>h2", то пар в конце процесса перегрет, и его свойства определяют по таблице для однофазной области интерполяцией на изобаре р2.
Проще всего решать задачи на процесс дросселирования с помощью диаграммы h,s. Определив начальную точку процесса как точку пересечения изобары p1с изотермой Т1(либо с кривой x1 = const), проводят через эту точку параллельно оси абсцисс линию h = const до пересечения с изобарой р2и таким образом определяют состояние пара в конце процесса.
2.6. Процесс течения
Процесс течения является основным рабочим процессом в паровой турбине, в которой пар под влиянием разности давлений с большой скоростью вытекает из сопел, попадает на лопатки рабочего колеса и отдает ему свою кинетическую энергию.
Расчет процесса течения газа (либо жидкости) заключается в определении скорости течения и двух каких-либо термодинамических свойств движущегося газа как функции пространственных координат. Другие характеристики движения могут быть вычислены по известным значениям этих трёх величин.
Ограничившись случаем, когда газ не совершает техническую работу (и к нему не подводится работа извне), запишем основное уравнение термодинамики для стационарного потока (2.13) в виде
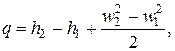 | (2.14) |
откуда следует
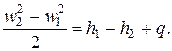 | (2.15) |
Из уравнения (2.15) видно, что приращение кинетической энергии газа происходит за счет уменьшения его энтальпии и подвода теплоты.
При непрерывном течении каждый элемент потока находится термодинамическом равновесии и имеет определенные значения параметров состояния, непрерывно изменяющиеся во времени и в пространстве. Таким образом, элемент потока при движении совершает термодинамический процесс, который аналогичен статическому процессу. Однако в статическом процессе параметры рабочего тела изменяются одновременно во всех его частях, а при течении процесс происходит последовательно во времени с каждым элементом. Оба процесса могут быть описаны одним и тем же уравнением, вид которого определяется только внешними воздействиями, оказываемыми на поток — подводом теплоты и перепадом давлений в канале.
Для наблюдателя, перемещающегося вместе с потоком, основное уравнение термодинамики записывается в виде (2.3):
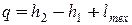 . . |
На основании этого уравнения и (2.15) получим
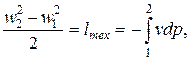 | (2.16) |
то есть изменение кинетической энергии потока равно технической работе статического процесса, уравнение которого совпадает с уравнением процесса, совершаемого элементом потока. Если известно это уравнение в координатах р,v,можно рассчитать изменение кинетической энергии по формуле (2.16). Определив затем по параметрам начального и конечного состояний значения энтальпии h1и h2, можно вычислить количество теплоты, подведенной к потоку, по уравнению (2.14).
Уравнения (2.13)–(2.15) справедливы как при наличии, так и при отсутствии в потоке трения, обусловленного силами вязкости, поскольку закон сохранения энергии, на основании которого получено уравнение (2.13), справедлив для любых процессов. Для ряда технически важных задач представляет интерес течение без трения и теплообмена (обратимое или идеальное адиабатное течение). Такой процесс является изоэнтропным, и для него справедливо равенство
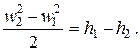 | (2.17) |
Из (2.17) следует, что при обратимом адиабатном течении скорость потока на выходе из канала равна
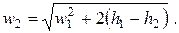 | (2.18) |
При истечении газа из сосуда большого объёма начальное значение скорости невелико и им можно пренебречь. В этом случае
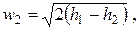 | (2.19) |
где размерность w – м/с, h – Дж/кг.
Если значения h выразить в кДж/кг, формула (2.19) принимает вид
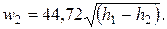 | (2.20) |
Значение разности энтальпий h1 – h2для любого реального газа, в том числе и для водяного пара, можно легко определить по диаграмме h,s,проведя линию s = const из начальной точки до пересечения с изобарой, соответствующей конечному давлению р2(рис. 2.6).
Для идеального газа можно подставить в формулу (2.19) вместо разности энтальпий известное выражение для технической работы изоэнтропного процесса. Тогда формула для скорости обратимого адиабатного течения идеального газа (при условии w1=0) примет вид
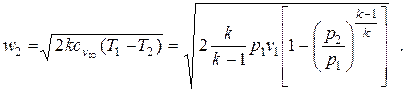 | (2.21) |
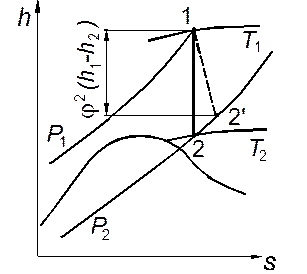 Рис. 2.6. Процесс течения реального газа на диаграмме h,s. Рис. 2.6. Процесс течения реального газа на диаграмме h,s. |
На практике имеет место реальное (необратимое) адиабатное течение при наличии трения. Если сопоставить между собой реальный и идеальный процессы течения при одинаковых условиях, то сумма, фигурирующая в правой части уравнения (2.14), будет одной и той же в обоих случаях, но значения слагаемых будут разными. При трении часть кинетической энергии потока превращается в теплоту, которая воспринимается им и вызывает рост энтальпии, поэтому конечная скорость окажется меньше, а конечное значение энтальпии больше, чем в идеальном случае.
Реальная скорость потока w2Допределяется через скорость идеального течения по формуле
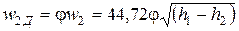 , , | (2.22) |
где φ – скоростной коэффициент.
Значение φ, определяемое по опытным данным, меньше 1 и зависит от рода текущего вещества, состояния поверхности канала и других факторов. Для сопл паровых турбин, имеющих достаточно гладкую поверхность, значение φ находится в пределах 0,95–0,98.
Поскольку трение приводит к изменению энтальпии и других параметров потока, можно условно изображать необратимое адиабатное течение на термодинамических диаграммах, полагая, что теплота трения подводится извне. Этот процесс, сопровождающийся ростом энтропии, на энтропийных диаграммах расположен правее линии s = const, проведенной из начальной точки. На основании формул (2.19) и (2.22) получим
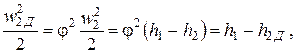 | (2.23) |
где h2Д>h2 –– действительное значение энтальпии потока при заданном конечном давлении р2.
Из уравнения (2.23) вытекает формула для определения величины h2Д
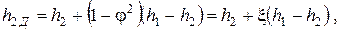 | (2.24) |
где ξ = 1–φ2 — коэффициент потери энергии.
Следовательно, если на диаграмме h,s от начальной точки изоэнтропы отложить вниз отрезок φ2(h1—h2) либо от конечной точки отложить вверх отрезок ξ(h1—h2) и из его конца провести горизонтальную прямую до пересечения с изобарой р2, то точка пересечения 2' будет соответствовать реальному конечному состоянию потока вещества. Таким путём можно определить ряд промежуточных состояний при различных давлениях и построить кривую реального процесса (изображенную штриховой линией на рис. 2.6).
Определив по диаграмме h,s значения температуры и энтропии в ряде промежуточных точек реального процесса, можно построить его на диаграмме Т,s (рис.2.7). На этой диаграмме изменение энтальпии изображается площадью под изобарой. Так как при умеренных давлениях изобары в области жидкости практически совпадают с пограничной кривой, приращение кинетической энергии потока при идеальном адиабатном течении, равное h1–h2, изобразится площадью 1–2–3–4, ограниченной двумя крайними изобарами, изоэнтропой и пограничной кривой жидкости. Площадь а–2–2'–b изображает разность энтальпий в конце реального и идеального процессов h2Д–h2, соответствующую потере кинетической энергии вследствие трения. Площадь а–1–2'–b под кривой реального процесса соответствует теплоте, эквивалентной работе тре- ния. Из диаграммы Т,s видно, что потеря кинетической энергии меньше
работы трения. Это объясняется тем, что работа трения превращается в теплоту, которая воспринимается потоком и на последующих этапах процесса восстанавливает часть потерянной кинетической энергии.
Если бы процесс 1–2' протекал обратимо с подводом теплоты от внешнего источника, то в соответствии с уравнением (2.15) приращение кинетической энергии потока изображалось бы площадью 1–2'–2–3–4, то есть было бы больше, чем при реальном и даже при идеальном адиабатном течении. Следовательно, внутренний подвод к потоку теплоты трения не эквивалентен подводу того же количества теплоты извне.
Для определения профиля канала, по которому движется поток, необходимо рассмотреть вопрос о форме струи газа при его течении. Из уравнения (2.1) получим уравнение для приращения кинетической энергии потока в дифференциальной форме
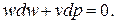 | (2.25) |
Для изоэнтропного процесса уравнение (2.25) можно записать в виде
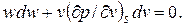 | (2.26) |
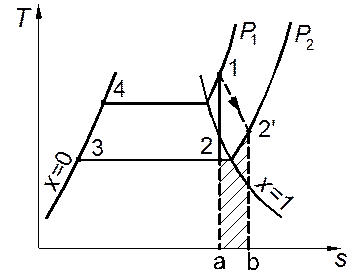 Рис. 2.7. Процесс действительного течения пара на диаграмме Т,s. Рис. 2.7. Процесс действительного течения пара на диаграмме Т,s. |
Производная (∂p/∂v)s связана со скоростью распространения звука а соотношением
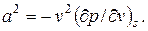 | (2.27) |
Учитывая (2.27), представим уравнение (2.26) в виде
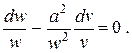 | (2.28) |
Для стационарного потока справедливо уравнение сплошности
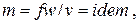 | (2.29) |
где т — массовый расход,
f –– площадь поперечного сечения.
После логарифмирования и дифференцирования уравнения сплошности получим
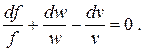 | (2.30) |
Выразив из (2.28) величину dv/v и подставив ее в (2.30), получим окончательно
 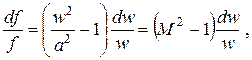 | (2.31) |
где M = w/a –– так называемое число Маха (отношение скорости течения потока к местной скорости звука).
Уравнение (2.31) связывает изменение площади поперечного сечения струи при идеальном адиабатном течении без совершения технической работы с изменением скорости потока и с числом Маха. Анализируя это уравнение, рассмотрим сначала случай, когда скорость потока надо увеличить (dw>0). Число Маха при этом условии возрастает, так как при изоэнтропном расширении давление и температура газа понижаются и скорость звука уменьшается. Тогда из (2.31) следует, что при M<1 df<0, а при M>1 df>0. Следовательно, при ускоренном движении потока, имеющего дозвуковую скорость и достигающего при движении сверхзвуковой, струя газа вначале сужается, а затем расширяется. В минимальном (переходном) сечении при df =0 M=1, то есть скорость течения потока равна скорости распространения звука в нём. Профиль канала, по которому движется газ, во избежание потерь кинетической энергии должен соответствовать рассмотренной форме струи.
Скорость звука в жидкостях существенно больше, чем в газах, поэтому течение жидкостей всегда происходит при дозвуковых скоростях (М<1), и для ускорения движения жидкости сечение канала должно уменьшаться (df<0).
В так называемом струйном компрессоре или эжекторе наряду с ускоренным течением имеет место замедленное (диффузорное) течение, при котором кинетическая энергия струи переходит в потенциальную и давление потока в направлении движения возрастает. При замедленном течении dw<0 ииз уравнения (2.31)видно, что при М>1 df<0, а при M<1 df>0. Таким образом, если течение потока начинается при сверхзвуковых скоростях и заканчивается при дозвуковых, канал должен иметь сначала сужающуюся часть, а затем расширяющуюся.
При адиабатном течении с трением описанная форма струи сохраняется, но в минимальном сечении скорость потока несколько отличается от местной скорости звука. При ускоренном движении потока сечение, в котором М=1, находится в расширяющейся части струи.
Скорость течения, совпадающая с местной скоростью звука, называется критической, а давление в соответствующем сечении — критическим давлением истечения рк. Отношение величины рк к давлению p1 заторможенного потока в начальном сечении, в котором можно пренебречь скоростью w1, называется критическим отношением давлений βк. Если отношение давления среды ра,в которую происходит истечение, к давлению p1больше значения βк, канал должен иметь только сужающуюся часть, в противном случае он имеет также расширяющуюся часть. Сопло, состоящее из сужающейся и расширяющейся частей, впервые применил для получения сверхзвуковых скоростей течения газа шведский инженер Лаваль в конце XIX века.
Для изоэнтропного течения идеального газа критическое отношение давлений и критическую скорость течения можно определить аналитически. Сочетая уравнение для скорости течения идеального газа (2.21) с уравнением сплошности (2.29), получим следующее выражение для расчета площади поперечного сечения струи, соответствующего давлению р
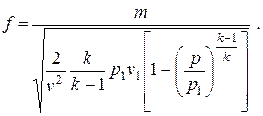 | (2.32) |
Подставив в (2.32) выражение 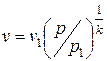 , получим
, получим
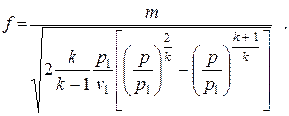 | (2.33) |
При заданных величинах p1 и v1 площадь поперечного сечения канала зависит только от отношения давлений p/p1= β, фигурирующего под корнем. Выражение в квадратных скобках обозначим через ψ
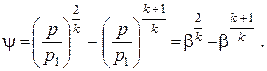 | (2.34) |
Из выражения для ψ видно, что оно дважды обращается в нуль: при β=0 и при β=1. Следовательно, функция ψ(β) имеет экстремум в интервале изменения β от 0 до 1. Взяв производную dψ/dβ и приравняв её нулю, найдём то отношение давлений, при котором ψ имеет максимум, а значит, f имеет минимум. Это отношение давлений называется критическим и оказывается равным
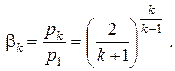 | (2.35) |
Оно зависит от числа атомов в молекуле газа и равно 0,528 для двухатомного газа и 0,546 для трехатомного (при значении показателя адиабаты k = 1,3). Для водяного пара как реального газа величина βк является переменной и зависит от начальных параметров потока, но в области перегретого пара при умеренных давлениях с приемлемой точностью можно принимать значение βк = 0,546, а для насыщенного пара βк = 0,577. При оценочных расчетах принимают βк ≈ 0,5.
Подставив в формулу (2.21) выражение для βк, определим критическую скорость течения идеального газа
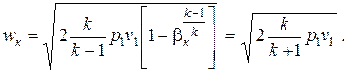 | (2.36) |
Профилирование сопла заключается в определении зависимости площади поперечного сечения от длины сопла. В простейшем случае расширяющаяся часть сопла имеет коническую форму с углом раствора γне более 12º (во избежание отрыва потока от стенок). Тогда достаточно определить диаметры минимального и выходного сечений dminи d2,после чего можно рассчитать длину расширяющейся части l
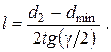 | (2.37) |
Сужающуюся часть сопла чаще всего не рассчитывают, а профилируют так, чтобы сглаженный входной участок плавно сопрягался с минимальным сечением.
Площадь поперечного сечения определяют на основании уравнения сплошности
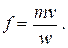 | (2.29a) |
Значение скорости w вычисляют по формуле (2.20) для идеального течения либо по (2.22) для теченияс трением. Значения удельного объёма v во всех сечениях находят по диаграмме h,s либо по таблицам.
При известном значении р2= ра определение скорости и удельного объёма пара на выходе из сопла и расчет выходного сечения по уравнению (2.29а) не вызывает затруднений. Однако для водяного пара расчет давления pкв минимальном сечении с учетом приведенных выше значений βк носит приближенный характер, особенно при наличии трения. Поэтому для точного расчета сопла необходимо построить процесс течения на диаграмме h,s,определить значения w и v при промежуточных давлениях и рассчитать соответствующие значения f. Построив график зависимости f от р, можно найти минимальное сечение fmin ,а затем вычислить значения dmin, d2и длину сопла. Для повышения точности определения fminцелесообразно при нахождении величин w и v использовать таблицы свойств и принимать меньший шаг по давлению в окрестности значения рк ,вычисленного по формуле pк = p1βк .
Если внешние условия изменяются по сравнению с теми, для которых рассчитано сопло, то некоторые характеристики процесса течения могут изменяться в определённых пределах. В качестве примера рассмотрим случай, когда имеется сужающееся сопло и уменьшается давление среды ра, в которую происходит истечение,таким образом, что получается серия установившихся режимов течения при различных значениях ра. Пока отношение pa/p1превышает значение βк, скорость на выходе возрастает и соответственно растет массовый расход пара т. При pa/p1 = βк в выходном сечении установятся критическое давление истечения и критическая скорость и значение т станет максимальным. Дальнейшее уменьшение давления среды не изменит давление на выходе из сопла, скорость истечения и, следовательно, расход пара. Расширение пара за соплом от давления р2= ркдо давления ра будет происходить неупорядоченно и сопровождаться вихреобразованием, при котором кинетическая энергия потока превращается в тепловую.
В случае истечения из отверстия в стенке резервуара либо из трубы постоянного сечения и при изменении давления среды скорость потока на выходе изменяется таким же образом, как при истечении из сужающегося сопла. Однако тогда при любых значениях ра возникают завихрения потока перед входом в трубу и при выходе из неё, вызывающие потери энергии. Более подробно вопрос о течении газа при режиме, отличающемся от расчетного, рассмотрен в учебной литературе.
Расчет процесса течения обычно выполняют, используя диаграмму h,s. Здесь могут встретиться те же три частных случая, что и при расчете изоэнтропного процесса расширения (§ 2.4). Процесс идеального адиабатного течения, как изоэнтропный, изображается на этойдиаграмме линией s = сonst, а для построения реального процесса течения при наличии трения надо знать скоростной коэффициент φ и найти ряд промежуточных состояний. Заметим, что иногда идеальный процесс, начавшийся в однофазной области, может заканчиваться в двухфазной, а совершающийся в том же интервале давлений реальный процесс полностью расположен в однофазной области, так как конечные значения энтальпии и энтропии во втором случае больше, чем в первом (процессы 1–2 и и 1–2' на рис. 2.7). Определив по диаграмме значения разности энтальпий h1-h и удельного объёма для конечного и ряда промежуточных давлений, рассчитываем соответствующие значения w и f и находим размеры сопла по методике, изложенной выше.
Процесс течения, как и рассмотренные ранее процессы, может быть рассчитан с помощью таблиц термодинамических свойств, но этот способ является более трудоёмким, чем расчет по диаграмме h,s. Целесообразно основные расчеты выполнять по диаграмме, привлекая дополнительно таблицы для уточнения значений удельного объёма.
