Термодинамические процессы
Всякое изменение состояния системы, связанное с изменением хотя бы одного термодинамического параметра называют термодинамическим процессом. Если изменение происходило вследствие химического превращения – называется реакций.
В зависимости от того какие параметры системы при переходе ее из одного состояния в другое остаются постоянными процессы делятся на изохорные (v = const), изобарные (Р = const), изотермические (Т = const).
Если система во время процесса изолирована от внешней среды таким образом, что исключен теплообмен со средой, процесс будет адиабатным. Процесс, при котором система, пройдя ряд промежуточных состояний, возвращается в исходное состояние с начальными значениями всех своих свойств (объема, давления, температуры и т.д.) называется круговым.
Круговые процессы интересны тем, что они не связаны с превращениями, поскольку начальное и конечное состояние системы совпадают. В зависимости от того, как изменяются параметры системы, процессы делятся на равновесные (квазистатические) и не равновесные.
Равновесным называется процесс, представляющий собой непрерывную последовательность равновесных состояний, при которых система в любой момент находится в равновесном состоянии. Отсюда следует, что равновесным, по существу, может быть только процесс, протекающий без разности потенциалов. Но т.к. разность потенциалов является движущей силой процесса, следует считать, что равновесный процесс – это процесс происходящий под действием бесконечно малой разности потенциалов.
В качестве примера рассмотрим процесс медленного расширения газа. (рис. 1.1)
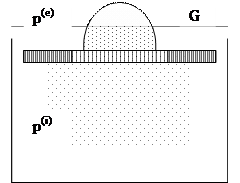 |
Рис. 1.1 Схема процесса равномерного расширения газа
Газ под действием груза G расположенного на поршне, находится в равновесном состоянии при давлении p(i) . Если снять с поршня небольшой груз, несоизмеримо малый по сравнению с грузом G («песчинку»), то внешнее давление уменьшится на некоторую очень малую величину (если считать, что трения нет) поршень начнет перемешаться. При этом внешнее давление p(e) практически можно считать равным внутреннему, а систему в таком процессе равновесной.
После того как давление p(e) и p(i) станут абсолютно равными можно снять еще одну песчинку и опять произойдет очень медленное перемещение поршня и незначительное, практическое равновесное изменение состояния системы, т.к. при таком бесконечно медленном расширении газа мы всегда практически можем считать, что внешнее давление равно внутреннему.
p(e) = p(i)
Равновесный процесс является условным, идеализированным понятием. Однако это понятие может быть применено для установления общих закономерностей термодинамики, а также для расчета многих реальных процессов. Их часто называют обратимыми. Этим понятием подчеркивается, что процесс можно провести как в прямом, так и в обратном направлениях через одни и те же равновесные состояния и работа расширения и работа сжатия будут равны и будут определять максимальную работу процесса А max.
Количество энергии, отданное окружающей среде в виде работы, равно количеству энергии, воспринятому системой в том же виде – в виде работы.
А max = 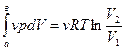 (1.3)
(1.3)
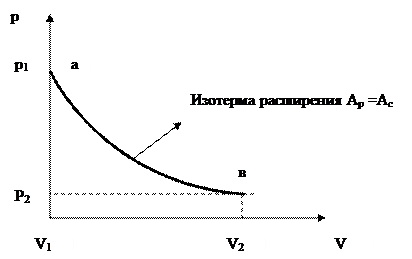 Графически это можно изобразить следующим образом:
Графически это можно изобразить следующим образом:
Рис. 1.2 Равновесное расширение и сжатие газа
Таким образом, для равновесных (обратимых) процессов характерны следующие особенности:
1. термодинамические параметры системы всегда можно считать равными параметрам окружающей среды;
2. система в любой момент процесса может оставаться находящейся в равновесном состоянии;
3. количество энергии отданное окружающей средой системе в определенной форме, всегда равно количеству энергии, воспринятому системой в той же форме.
Эти особенности очень важны для термодинамики, так как дают возможность оперировать параметрами состояния системы при анализе процессов и определять количества теплоты и работы.
Все реальные процессы протекают с конечной скоростью обусловленной конечной разностью в давлениях и температурах между системой и внешней средой. Они являются потому неравновесными.
На рис. 1.3 в координатах р-v процесс неравномерного расширения газа изображен нисходящей ломанной линией, число ступенек которой равно числу снятых с поршня грузов. Площадь между ломанной линией и осью абсцисс будет равна совершенной работе в процессе расширения газа (Ар). При проведении обратного поршень будет постепенно нагружаться гирьками и тем самым сжимать газ. Процесс сжатия изображен восходящей ломанной линией. Площадь между нею и осью абсцисс будет равна работе сжатия (Ас) затраченной на сжатие газа.
Из рис. 1.3. следует, что Ас > Ар и Ас > Amax, Ар < Amax. Таким образом, неравновесные процессы являются необратимыми и сопровождаются потерей работоспособности системы.
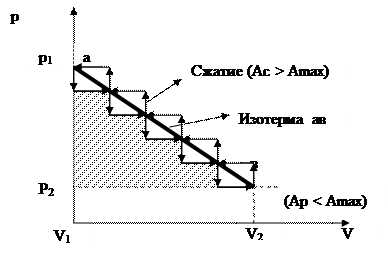 |
Рис. 1.3 Неравномерного расширение (сжатие) газа.
Внутренняя энергия
Энергия представляет собой общую меру различных форм движения материи. Соответственно формам движения материи различают и виды энергии – механическую, электрическую, химическую и т.д. Всякая термодинамическая система в любом состоянии обладает некоторым запасом энергии, существование которой было доказано Р.Клаузиусом (1850) и получило название внутренней энергии.
Внутренняя энергия (U) – это энергия всех видов движения микрочастиц, составляющих систему, и энергия их взаимодействия между собой.
Внутренняя энергия складывается из энергии поступательного, вращательного и колебательного движения частиц, энергии межмолекулярного и внутримолекулярного, внутриатомного и внутриядерного взаимодействий и др.
Энергию внутримолекулярного взаимодействия, т.е. энергию взаимодействия атомов в молекуле, часто называют химической энергией. Изменение этой энергии имеет место при химических превращениях.
Для термодинамического анализа нет необходимости знать из каких форм движения материи складывается внутренняя энергия.
Запас внутренней энергии зависит только от состояния системы. Следовательно, внутреннюю энергию можно рассматривать как одну их характеристик этого состояния наравне с такими величинами, как, давление, температура.
Каждому состоянию системы соответствует строго определенное значение каждого из его свойств.
Если гомогенная система в начальном состоянии имеет объем V1, давление P1, температуру T1, внутреннюю энергию U1, удельную электропроводность æ1 и т.д., а в конечном состоянии эти свойства соответственно равны V2, P2, T2, U2, æ2 и т.д., то изменение каждого свойства при переходе системы из начального состояния в конечное будет одним и тем же, независимо от того, каким путем переходит система из одного состояния в другое: первым, вторым или третьим (рис. 1.4).
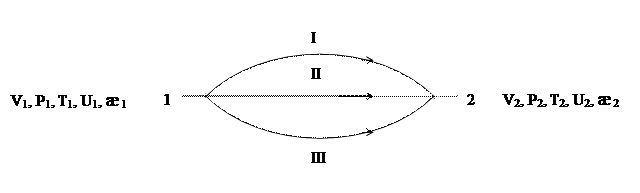 |
Рис. 1.4 Независимость свойств системы от пути ее перехода
из обычного состояния в другое
Т.е. (U2 - U1)I = (U2 - U1)II = (U2 - U1)III (1.4)
Где цифры I, II, III и т.д. указывают пути процесса. Следовательно, если система из начального состояния (1) в конечное (2) перейдет по одному пути, а из конечного в начале – по другому пути, т.е. совершится круговой процесс (цикл), то изменение каждого свойства системы будет равно нулю.
Таким образом, изменение функции состояния системы не зависит от пути процесса, а зависит лишь от начального и конечного состояний системы. Бесконечно малое изменение свойств системы обозначается обычно знаком дифференциала d. Например, dU – бесконечное малое изменение внутренней энергии и т.д.
Формы обмена энергией
В соответствии с различными формами движения материи и различными видами энергии существуют различные формы обмена энергией (передача энергии) – формы взаимодействия. В термодинамике рассматриваются две формы обмена энергии между системой и окружающей средой. Это работа и теплота.
Работа. Наиболее наглядной формой обмена энергией является механическая работа, соответствующая механической форме движения материи. Она производится при перемещении тела под действием механической силы. В соответствии с другими формами движения материи различают и другие виды работы: электрическую, химическую и т.д. Работа является формой передачи упорядоченного, организованного движения, так как при совершении работы частицы тела движутся организованно в одном направлении. Например, совершение работы при расширении газа. Молекулы газа, находящегося в цилиндре под поршнем, находятся в хаотическом, неупорядоченном движении. Когда же газ начнет перемещать поршень, то есть совершать механическую работу, на беспорядочное движение молекул газа будет накладываться организованное движение: все молекулы получают некоторое смещение в направлении движения поршня. Электрическая работа так же связана с организованным движением в определенном направлении заряженных частиц материи.
Поскольку, работа является мерой передаваемой энергии, количество ее измеряется в тех же единицах, что и энергия.
Теплота. Форму обмена энергией, соответствующую хаотическому движению микрочастиц, составляющих систему, называют теплообменом, а количество энергии, переданное при теплообмене, называют теплотой.
Теплообмен не связан с изменением положения тел, составляющих термодинамическую систему, и состоит в непосредственной передаче энергии молекулами одного тела молекулам другого при их контакте.
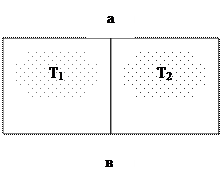 Представим себе изолированный сосуд (систему) разделенную на две части теплопроводной перегородкой ав (рис. 1.5). Допустим, что в обеих частях сосуда находится газ.
Представим себе изолированный сосуд (систему) разделенную на две части теплопроводной перегородкой ав (рис. 1.5). Допустим, что в обеих частях сосуда находится газ.
Т1
Рис. 1.5. К понятию о теплоте
В левой половине сосуда температура газа Т1, а в правой Т2. Если Т1 > Т2, то средняя кинетическая энергия ( 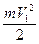 ) молекул газа в левой части сосуда, будет больше средней кинетической энергии (
) молекул газа в левой части сосуда, будет больше средней кинетической энергии ( 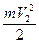 ) в правой половине сосуда.
) в правой половине сосуда.
В результате непрерывных соударений молекул о перегородку в левой половине сосуда часть энергии их передается молекулам перегородки. Молекулы же газа, находящегося в правой половине сосуда, сталкиваясь с перегородкой, приобретут какую-то часть энергии от ее молекул.
В результате этих столкновений кинетическая энергия молекул в левой половине сосуда будет уменьшаться, а в правой – увеличиваться; температуры Т1 и Т2 будут выравниваться.
Поскольку теплота является метой энергии, ее количество измеряется в тех же единицах, что энергия. Таким образом, теплообмен и работа являются формами обмена энергией, а количество теплоты и количество работы - мерами передаваемой энергии. Различие между ними состоит в том, что теплота – это форма передачи микрофизического, неупорядоченного движения частиц (и, соответственно, энергии этого движения), а работа представляет собой форму передачи энергии упорядоченного, организованного движения материи.
Иногда говорят: теплота (или работа) подводится или отводится от системы, при этом следует понимать, что подводиться и отводится не теплота и работа, а энергия, поэтому следует не употреблять такого рода выражений как «запас теплоты» или «теплота содержится».
Являясь формами обмена энергией (формами взаимодействия) системы с окружающей средой, теплота и работа не могут быть связаны с каким-либо определенным состоянием системы, не могут являться ее свойствами, а, следовательно, и функциями ее состояния. Это означает, что если система проходит из начального состояния (1) в конечное (2) различными путями, то теплота и работа будут иметь разные значения для разных путей перехода (рис. 1.6)
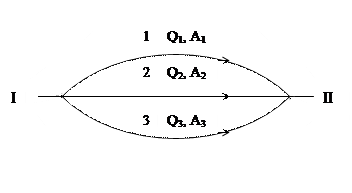
Рис. 1. 6
Конечное количество теплоты и работы обозначают Q и A, а бесконечно малые значения соответственно через δQ и δA. Величины δQ и δA в отличие от dU не являются полным дифференциалом, т.к. Q и A не являются функциями состояния.
Когда же путь процесса буде предопределен, работа и теплота приобретут свойства функций состояния системы, т.е. их численные значения будут определяться только начальным и конечным состояниями системы.
