Опыт 8. Окислительные свойства диоксида свинца
A. Окисление сульфата хрома (III). В пробирку с диоксидом свинца добавить 10 капель 40 %-ного раствора едкого натра. Пробирку нагреть на водяной бане или закрепить в штативе и осторожно нагреть на горелке. В горячий раствор внести 1 каплю раствора сульфата хрома и снова нагреть пробирку. Отметить появление желтой окраски раствора, характерной для иона 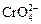 .
.
Написать уравнение реакции, учитывая что сульфат и хромат свинца (II) – мало растворимы в воде, растворимы в едких щелочах с образованием гексагидроксоплюмбатов (II).
Б. Окисление иодида калия. В пробирку внести один микрошпатель порошка диоксида свинца, 3–5 капель 2 н. раствора серной кислоты и 5–6 капель раствора иодида калия. Нагреть пробирку маленьким пламенем горелки или на водяной бане. Отметить изменение цвета раствора. Перенести стеклянной палочкой каплю этого раствора в пробирку с 8–10 каплями раствора крахмала. Отметить появление синей окраски. Написать уравнение реакции взаимодействия диоксида свинца с иодидом калия в кислой среде.
В. Окисление сульфата марганца (II). В пробирку поместить очень немного (на кончике микрошпателя) диоксида свинца, добавить 6–8 капель 2 н. раствора азотной кислоты и одну каплю раствора соли марганца (II). Содержимое пробирки осторожно прокипятить. При избытке диоксида свинца пробирку поставить в штатив и дать раствору отстояться. Отметить окраску полученного раствора. Запись данных опыта. Написать уравнение реакции, учитывая, что образовались марганцовая кислота и соль свинца (II).
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций, ответы на вопросы.
Лабораторная работа № 5. Свойства элементов V А группы
Цель работы: изучение химических свойств элементов V А .группы.
Азот
Общие сведения
К главной подгруппе V А группы периодической системы принадлежат азот, фосфор, мышьяк, сурьма и висмут. Элементы V А группы имеют пять электронов на внешнем уровне, что предполагает способность к присоединению электронов. Соответственно степень окисления может изменяться от −3 (кроме висмута) до +5. Электроотрицательность элементов V А группы сравнительно невелика. Поэтому бинарные соединения с водородом не обладают достаточной ионностью связи и не обладают кислотными свойствами.
При переходе от азота к висмуту наблюдается изменение свойств от неметалла (азот, фосфор) к металлу (висмут). Мышьяк и сурьма в равной степени обладают как свойствами металла, так и свойствами неметалла.
Молекулярный азот – химически малоактивное вещество. При обычных условиях взаимодействует только с литием. Малая активность азота объясняется большой прочностью тройной связи атомов в молекуле. При высоких температурах вступает во взаимодействие с активными металлами и некоторыми неметаллами.
Среди соединений азота с водородом наибольшую известность имеет аммиак. За счет того, что в молекуле аммиака азот имеет степень окисления −3, он обладает восстановительными свойствами. В атмосфере кислорода аммиак горит, при этом образуется вода и свободный азот. За счет неподеленной электронной пары азота аммиак способен образовывать химические связи по донорно-акцепторному механизму, следовательно, для аммиака характерны реакции присоединения и комплексообразования. Большинство солей аммония растворимо. Т.к. гидроксид аммония – раствор аммиака в воде – имеет свойства слабого основания, то соли аммония в растворах гидролизуются. Все соли аммония термически неустойчивы.
С кислородом азот образует пять оксидов, из которых формальными ангидридами кислот являются N2O3 и N2O5. Оксиды азота имеют кислотный (N2O3, N2O5, NO2) или безразличный (N2O, NO) характер. Наиболее устойчивым является оксид азота (IV).
Азотистая кислота HNO3 принадлежит к числу слабых кислот pK = 4 и известна только в сильно разбавленных водных растворах. При концентрировании раствора или просто при его нагревании азотистая кислота распадается: 2HNO2 = NO + NO2 + H2O. Соли азотистой кислоты – нитриты – в водных растворах подвержены гидролизу. Степень окисления азота в азотистой кислоте равна +3, поэтому HNO2 и нитриты проявляют окислительно-восстановительную двойственность. Под действием окислителей окисление обычно идет до азота, в реакциях с восстановителями N+3 обычно восстанавливается до NO.
Азотная кислота принадлежит к числу наиболее сильных кислот. Характерным свойством азотной кислоты является ее ярко выраженная окислительная способность и отсутствие образования водорода. Для концентрированной азотной кислоты характерно явление пассивации металлов (железо, хром, алюминий). Продуктами восстановления азота в азотной кислоты в зависимости от концентрации кислоты и активности восстановителя являются: NO2, N2O3, NO, N2O, N2, NH4NO3. В направлении от NO2 к NH4NO3 увеличивается активность восстановителя, уменьшается концентрация кислоты.
Соли азотной кислоты называют нитратами. Все нитраты хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. Другие продукты разложения зависят от положения металла в ряду напряжений: нитраты активных металлов (до Mg) разлагаются на нитрит и кислород; нитраты благородных металлов разлагаются на металл, оксид азота (IV) и кислород; нитраты остальных металлов разлагаются на оксид металла, оксид азота (IV) и кислород. В кристаллическом состоянии нитраты при высокой температуре являются сильными окислителями, однако это свойство теряется для растворов солей азотной кислоты.
Выполнение работы
