VII этап Домашнее задание
II этап. Изучение нового материала.
По ходу фронтальной беседы в целях подготовки учащихся к активному и сознательному усвоению материала предлагается запомнить таблицу:
Соединение железа и их связей.
1) Железо образует 2 вида оксидов и гидроксидов: FeO – оксид железа (II) – черный, Fe(OH)3-гидроксид железа (II) – белый, проявляют основные свойства: Fe2O3-оксид железа (III) – красно-бурый, Fe(OH)3-гидроксид железа (III)- бурый, проявляет амфотерные свойства.
2) Fe2+,Fe3+. Растворимые соли ионов Fe2+,Fe3+ реагируют при комнатной температуре с растворами щелочей:
FeSO4 + NaOH 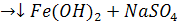
FeCl3 +3 NaOH 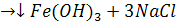
3) Оксид и гидроксид желез (II) вступают в реакцию с кислотами
FeO +2HCl = FeCl2 + H2O
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
4) Оксид железа (III) и гидроксид железа (III) амфотерны, вступают в реакцию:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + Na2O= 2NaFeO2
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3NaOH = Na3[Fe(OH)6]
5) Гидроксиды железа (II) и (III) при нагревании разлагаются:
Fe(OH)2=FeO + H2O
2Fe(OH)3=Fe2O3+3H2O
6) Белый осадок гидроксида железа (II) на воздухе меняет окраску:сначала зеленоватая, затем бурая. Катионы железа (II) легко окисляются кислородом воздуха до катиона железа (III).
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Учитель благодарит всех за ответы и предлагает решить проблему:
1.различаются ли химические свойства соединений железа (II) и железа (III)?
2.Каким путем соли соединения железа (II) можно отличить отсолей соединения железа (III)?
III этап.
Проблемный вопрос:А как еще распознаются соли железа (II) и (III)?
Поиск решения:
Учащиеся каждой группы, пользуясь инструкцией по проведению лабораторной работы (инструкция прилагается), проводят исследование:
Инструкция по проведению лабораторной работы:
«Качественные реакции на ионы Fe 2+ и Fe3+»
Цель: научить проводить качественные реакции на ионы Fe 2+ и Fe3+, выработать умение формировать цель исследования; освоение поэтапного исследования с постепенным увеличением степени самостоятельности
Оборудование и реактивы: HCl, NaOH, FeCl3, FeSO4, K3[Fe(CN)6] – красная кровяная соль, K4[Fe(CN)6]-желтая кровяная соль, KCNS-роданид калия.
Дается готовый алгоритм исследовательской работы:
1. В пробирку №1 налейте раствор сульфата железа (II) , в пробирку №2 –хлорид железа(III). В обе пробирки прилейте раствор красной кровяной соли K3[Fe(CN)6]. Отметьте окраску полученных растворов.
2. В пробирку № 3 налейте раствор сульфата железа (II), в пробирку №4 – хлорида железа (III). В обе пробирки прилейте раствор желтой кровяной соли K4[Fe(CN)6] . Отметьте цвет полученного раствора.
3. В пробирку №5 налейте раствор хлорида железа (III). В эту же пробирку прилейте раствор роданида калия KCNS. Отметьте цвет полученного раствора.
Результаты опытов полученного раствора оформите в виде таблицы:
| № пробирки | Содержимое пробирок | Цвет содержимого до реакции | Цвет содержимого после реакции |
| FeSO4 | |||
| FeCl3 | |||
| FeSO4 | |||
| FeCl3 | |||
| FeCl3 |
Исследовательскую деятельность проводят самостоятельно. При необходимости консультируются с учителем. За каждый этап работы получают оценки.
IV этап. Учитель делает выводы: - обобщение темы:
1. При добавлении к раствору хлорида железа (III) раствора желтой кровяной соли образуется темно-синий осадок (берлинская лазурь)
4FeCl3 +3K4[Fe(CN)6]=↓Fe4[Fe(CN)6]+12KCl – это качественная реакция на ион Fe3+
2. При взаимодействие раствора сульфата железа (III) с раствором красной кровяной соли образуется темно-синий осадок (турнбулева синь) 3FeSO4 +2K3[Fe(CN)6]=Fe3[Fe(CN)6]+3K2 SO4 – это качественная реакция на ион Fe2+
3. Для обнаружения ионов Fe3+ также используется реакция с роданидом калия, смесь приобретает красный цвет:
FeCl3 +3KCNS=Fe(CNS)3+3KCl
V этап Самостоятельное применение знаний.
Проводиться лабораторный опыт:
предлагается :
1.В пробирку налейте 2 мл соляной кислоты, опустите скрепку (железо). Нагрейте содержимое (две минуты), соблюдая технику безопасности. Что наблюдается? Какая соль получилась? Создана проблема
Ученики высказывают разные мнения, чтобы проверить правильность предложения о формуле возможной соли, проводиться анализ на обнаружение ионов Fe 2+ и Fe3+
Cделать выводы. Написать уравнение реакций (решение проблемы)
VI этап Подведение итогов, выставление оценок
VII этап Домашнее задание.
Учебник О.С. Габриеляна §14 c. 65-67 упр.5(письменно)
Подумать над проведением опыта: Какая используя свойства соединений железа (II) и Fe(III) провести опыт: «Моментальная цветная фотография»
Ответ : Растворами солей железа (II) или (III), на белой бумаге выполняют рисунок, высушивают его (бумага остается неокрашенной).Для проявления таких рисунков по бумаге проводиться влажным тампоном, смоченным раствором желтой или красный кровяной соли.
2K4[Fe(CN)6]+Fe2(SO4)3=2↓KFe[(CN)6]+3 K2 SO4 - синяя окраска
K4[Fe(CN)6]+2СuSO4=Cu2 [Fe(CN)6]↓+2 K2SO4 - темно-коричневая окраска
42K3[Fe(CN)6]+4FeSO4=Fe4[Fe(CN)6]↓+4 K2 SO4 -темно- синяя окраска
Литература:
1. Учебники: - Габриелян О.С.
- Новошинский И. И.
- Савинкина Е. В.
- Журин А. С. Химический эксперимент.
Практические занятия.
2. Методические пособия:
- Настольная книга для учителя.
О. С. Габриеля
И. Г. Остроумов
- Основные классы неорганических веществ.
Дерябина Н. Е.
3. Контрольно – измерительные материалы:
- Химический тренажёр. А. М. Радецкий.
- ЕГЭ: Шаг за шагом.
- Контрольные работы (8 – 9 кл.) И. И. Новошинский. А. Ф. Федосова.
