Работа 5. Изучение реакций окисления-восстановления
Цель работы: проведение качественных опытов, раскрывающих окислительно-восстановительные свойства отдельных веществ; определение возможности протекания реакции в стандартных условиях по значению величин стандартных окислительно-восстановительных потенциалов.
Опыт 1. Сравнение химической активности железа и меди
Налейте в пробирку насыщенный раствор CuSO4 и опустите в него железную стружку.
Напишите уравнение реакции, используя метод электронного баланса (МЭБ), укажите значение стандартных потенциалов и отметьте ваши наблюдения:
CuSO4 + Fe =_______________________ ____
Наблюдения:_______________________
Рассчитайте ЭДС реакции и сделайте вывод о возможности самопроизвольного протекания реакции________________________________ __
Вывод:____________________________ __
Опыт 2. Термическое разложение перманганата калия
Поместите в пробирку небольшое количество кристаллического перманганата калия. Нагрейте и докажите выделение кислорода с помощью тлеющей лучинки.
Напишите уравнение реакции, используя метод электронного баланса:
KMnO4(тв) =_________________________ ______
Наблюдения:_________________________
Вывод:______________________________
(пояснение: определите тип окислительно-восстановительной реакции)
Опыт 3. Окислительные свойства нитратов
Поместите в пробирку небольшое количество стружки алюминия, добавьте концентрированный (30%) раствор щелочи и раствор нитрата натрия (или калия).
Напишите уравнение реакции, используя метод электронного баланса, укажите значения стандартных потенциалов и отметьте ваши наблюдения:
Al + KOH + KNO3 + H2O =_________ ____
Наблюдения:_______________________
Докажите выделение аммиака NH3 с помощью фильтровальной бумаги, смоченной индикатором фенолфталеином:______________________________
Вывод:____________________________ ____
(сделайте вывод о том, какие свойства проявляет нитрат натрия (или калия); укажите тип ОВР)
Опыт 4. Окислительные свойства соединений хрома (VI)
К 1-2 мл раствора дихромата калия, подкисленного серной кислотой (1 мл), прилейте 1-2 мл раствора нитрита калия или натрия. Реакция идет медленно, поэтому чтобы реакция прошла, следует подождать 5-10 мин. Приступайте к следующему опыту, а через 10 минут отметьте изменения, которые произошли в этой пробирке.
Напишите уравнение ОВР, отметьте ваши наблюдения:
K2Cr2O7 + H2SO4 + KNO2 =_________ ____
Наблюдения:_________________________
Вывод:____________________________ ____
(сделайте вывод о том, какие свойства проявляют соединения хрома (VI), укажите тип ОВР и рассчитайте ЭДС)
Опыт 5. Окислительно-восстановительные свойства нитрит-иона
Налейте в одну пробирку раствор перманганата калия, а в другую – иодид калия, и в каждую добавьте разбавленной серной кислоты. Затем в каждую пробирку добавьте немного раствора нитрита калия или натрия. Напишите уравнения реакций, укажите значение стандартных потенциалов, отметьте ваши наблюдения, рассчитайте ЭДС реакций.
1. KMnO4 + H2SO4 + KNO2 =_______ ________________________________Наблюдения:____________________ЭДС реакции:____________________ ________________________________
2. KI + H2SO4 + KNO2 =____________ ________________________________ Наблюдения:____________________ЭДС реакции:____________________ ________________________________
Вывод:__
(пояснение: охарактеризуйте окислительно-восстановительные свойства нитритов: в каком случае нитрит-ионы проявляют восстановительные свойства и в каком – окислительные свойства?)
Контрольные вопросы и упражнения
1. Определите тип окислительно-восстановительных реакций и расставьте коэффициенты методом электронного баланса:
а) 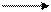 NH4NO3 t N2O + H2O
NH4NO3 t N2O + H2O
б)  PbS + HNO3(конц) t PbSO4 + NO2 + H2O
PbS + HNO3(конц) t PbSO4 + NO2 + H2O
в)  Hg(NO3)2 t Hg + NO2 + O2
Hg(NO3)2 t Hg + NO2 + O2
г)  KMnO4 + HCl(конц) Cl2 + MnCl2 + KCl + H2O
KMnO4 + HCl(конц) Cl2 + MnCl2 + KCl + H2O
2. Составьте уравнение реакции взаимодействия сульфата железа (II) с перманганатом калия в кислой среде. Используя электродные потенциалы соответствующих систем, рассчитайте ЭДС этого процесса.
3. Допишите уравнения реакций и расставьте коэффициенты, используя метод электронного баланса:
а) I2 + H2O2 = HIO3 + …
б) FeS + HNO3(конц)= H2SO4 +NO2 + …
в) KI + Fe2(SO4)3 =
г) KMnO4 + HBr =
4. Какой из окислителей является наиболее сильным: H2SO4(конц), K2Cr2O7, Cl2, KMnO4? Ответ обоснуйте, используя значения окислительно-восстановительных потенциалов.
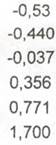
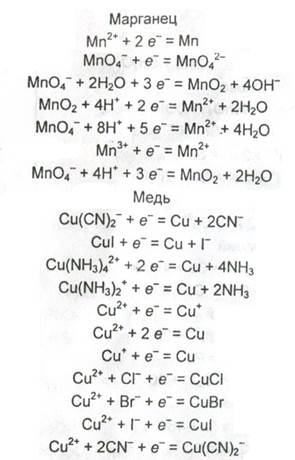
Таблица. Стандартные электродные потенциалы некоторых систем в водных растворах
| Уравнение процесса | φ°, В |
 |  |
| Хром Cr2+ + 2e– = Cr Cr3+ + 3e– = Cr Cr3+ + e– = Cr2+ CrO42– + 4H+ + 3e– = CrO2– + 2H2O Cr2O72– + 14H+ + 6e– = 2Cr3+ + 7H2O CrO42– + 8H+ + 3e– = Cr3+ + 4H2O | –0,913 –0,744 –0,407 0,945 1,333 1,477 |
 |   |
 |  |
