Свойства неорганических соединений
Основные понятия химии. Номенклатура неорганических веществ.
Вариант 0.
| Вещество (при н.у.) | Молярная масса, г/моль | Масса, г | Молярный объем, л/моль | Объем, л | Количество вещества, моль | Число структурных единиц |
| Pb | 6,21 | |||||
| SO2 | 4,48 |
Основные понятия химии.
Заполните таблицу.
Номенклатура неорганических соединений.
а) Укажите класс соединений и составьте эмпирические формулы соединений, соответствующие названиям:
| сульфид кадмия | оксид титана (IV) | гидросульфид калия |
| нитрат гидроксоолова(II) | фосфористая кислота |
б) Назовите соединения и укажите класс:
Ca3(PO4)2 FeOHSO3 Co(OH)3 HClO4 Ba(HCO3)2
Свойства неорганических соединений.
а) Какие из указанных оксидов являются основными, кислотными и амфотерными (приведите формулы соответствующих им гидроксидов (кислот и оснований): GeO2 Cr2O3 SiO2 Na2O CaO
Заполните таблицу.
| Типы оксидов | Формулы оксидов | Формулы соответствующих гидроксидов |
| Кислотные | ||
| Основные | ||
| Амфотерные |
б) Какие из указанных кислот образуют кислые соли? Составьте формулы этих солей: HPO3 H2S HNO2 HClO3 H3AsO3
в) Какие из указанных оснований образуют основные соли? Составьте формулы этих солей: Cu(OH)2 KOH Mg(OH)2 NaOH Fe(OH)2
4. Осуществить превращения:Zn ---- ZnO ---- ZnSO4 ----- Zn(NO3)2 ---- O2
Образец решения некоторых заданий
- Основные понятия химии.
Заполните таблицу.
| Вещество (агрегат. состояние при н.у.) | Молярная масса 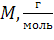 | Масса m, г | Молярный объем, 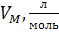 | Объем V, л | Количество вещества 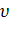 , моль , моль | Число структурных единиц N |
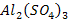 | 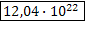 дано дано | |||||
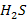 | 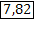 дано дано | |||||
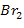 | 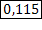 дано дано | |||||
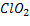 | 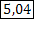 дано дано |
M – молярная масса вещества или масса 1 моль вещества. Рассчитывается по таблице Менделеева, измеряется в 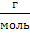
ν или n – количество вещества, измеряется в моль.
Для расчетов применяются формулы:
для веществ в любом агрегатном состоянии
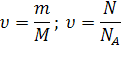
V
только для газов ν = -----
VM
m – масса вещества в г (граммах)
N – число структурных единиц (молекул, атомов или сочетание ионов)
NA – постоянная (или число) Авогадро, показывает, сколько структурных единиц
содержится в 1 моль любого вещества.

V – объем газа в л (литрах)
VM – молярный объем любого газ, т.е. объем 1 моль газа, измеряется в 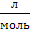 .
.
При н.у. 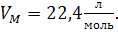
Используя три формулы для расчета количества вещества (ν или n) , заполним таблицу.
| Вещество (агрегатное состояние при н.у.) | Молярная масса 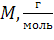 | ||||
| Al2(SO4)3 Соль, твердое вещество при н.у. | 1) по табл. Менделеева 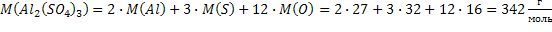 | ||||
| Масса m, г | Молярный объем, 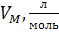 | Объем V, л | |||
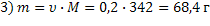 | при данных условиях невозможно определить, т.к. твердое вещество | ||||
Количество вещества 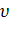 , моль , моль | Число структурных единиц N | ||||
2) 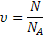 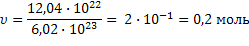 | 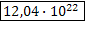 дано дано | ||||
| Вещество (агрегатное состояние при н.у.) | Молярная масса 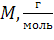 | Масса m, г | Молярный объем, 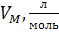 | ||
| H2S Сероводород при н.у. - газ | 1) по табл. Менделеева 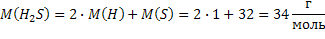 | 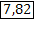 дано дано | 3) при н.у. для любого газа 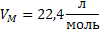 | ||
| Объем V, л | Количество вещества 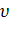 , моль , моль | ||||
4) 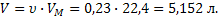 | 2) 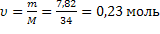 | ||||
| Число структурных единиц N | |||||
5) 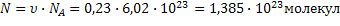 | |||||
| Вещество (агрегатное состояние при н.у.) | Молярная масса 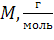 | Масса m, г | ||||
| Br2 Бром, при н.у. - жидкость | 1) по табл. Менделеева Г М(Br2) = 2∙М(Br) = 2∙ 80 = 160 ------ МОЛЬ | 2) 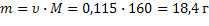 | ||||
Молярный объем, 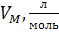 | Объем V, л | Количество вещества 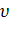 , моль , моль | Число структурных единиц N | |||
| при данных условиях невозможно определить, т.к. жидкое вещество | 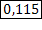 дано дано | 3) 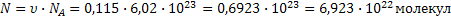 | ||||
| Вещество (агрегатное состояние при н.у.) | Молярная масса  | Масса m, г | |||
| ClO2 Оксид хлора (IV), при н.у. газ желто-бурого цвета | 1) по табл. Менделеева 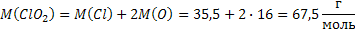 | 4) 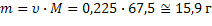 | |||
Молярный объем, 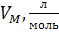 | Объем V, л | Количество вещества 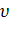 , моль , моль | Число структурных единиц N | ||
2) при н.у. для любого газа 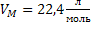 | 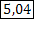 дано дано | 3) 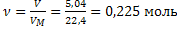 | 5) 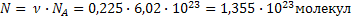 | ||
