Неконкурентное ингибирование
Данный вид ингибирования связан с присоединением ингибитора не в активном центре, а в другом месте молекулы. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо токсинов.
Например, синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.
Бывают ситуации когда ферменты не работают
В случае, если фермент не может выполнять свою функцию, говорят об энзимопатологии(энзимопатии).
Энзимопатологии (энзимопатии) – состояния, связанные с патологическим изменением активности ферментов. Наиболее часто встречается снижение активности и нарушение каких-либо метаболических процессов. В результате энзимопатологии клиническое значение может иметь
· накоплениесубстрата реакции, например: фенилаланина при фенилкетонурии, свободного билирубина при желтухах новорожденных, некоторых жиров при болезнях лизосомального накопления (липидозы),
· недостатокпродукта, например: меланина при альбинизме, катехоламинов при паркинсонизме,
· обе особенности одновременно, как при гликогенозах, сопровождающихся гипогликемией при избытке гликогена в печени.
По характеру нарушения выделяют первичные и вторичные энзимопатии.
Первичные (наследственные) энзимопатии связаны с генетическим дефектом и наследственным снижением активности. Например, фенилкетонуриясвязана с дефектом фенилаланин-4-монооксигеназы, которая превращает фенилаланин в тирозин. В результате накапливаются аномальные метаболиты фенилаланина, оказывающие сильный токсический эффект. Заболевание подагра связано с дефектом ферментов метаболизма пуриновых оснований и накоплением мочевой кислоты.
Кроме указанных, распространенными первичными энзимопатиями являются галактоземия, недостаточность лактазы и сахаразы, различныелипидозы.
Вторичные (приобретенные) энзимопатии возникают как следствие заболеваний органов, вирусных инфекций и т.п., что приводит к нарушению синтеза фермента или условий его работы, например, гипераммониемия при заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак. Другим примером может служить недостаточность ферментов желудочно-кишечного тракта при заболеваниях желудка, поджелудочной железы или желчного пузыря.
Недостатоквитаминов и их коферментных форм также является причиной приобретенных ферментопатий.
Ферменты востребованы в медицине
Использование ферментов в медицине происходит по четырем направлениям:
· энзимодиагностика,
· энзимотерапия,
· использование ферментов в медицинских технологиях и промышленности.
· применение ингибиторов ферментов
Энзимодиагностика
Энзимодиагностика – это исследование активности ферментов плазмы крови, мочи, слюны с целью диагностики тех или иных заболеваний. Примером может служить фермент лактатдегидрогеназа, определение его активности в плазме крови необходимо при заболеваниях сердца, печени, скелетной мускулатуры. Увеличение активности α-амилазы в плазме крови и моче наблюдается при воспалительных процессах в поджелудочной и слюнных железах.
С другой стороны, заболевания тех или иных органов всегда сопровождаются специфичным "ферментативным профилем". Например, инфаркт миокарда сопровождается увеличением активности лактатдегидрогеназы, креатинкиназы, аспартатаминотрансферазы.
Энзимотерапия
Энзимотерапия – это использование ферментов в качестве лекарственных средств.
Самыми распространенными ферментативными препаратами являются комплексы ферментов желудочно-кишечного тракта (Фестал, Панзинорм форте, Мезим форте, Энзистал и т.п.), содержащие пепсин, трипсин, амилазу и т.п., и используемые для заместительной терапии при нарушениях переваривания веществ в желудочно-кишечном тракте.
Тканевой фермент гиалуронидазанужна организму для обратимого изменения проницаемости межклеточного вещества, в основе которого находитсягиалуроновая кислота. Лекарственную форму гиалуронидазы – лидазу– вводят для размягчения рубцов, появления подвижности в суставах, рассасывания гематом.
Цитохром с – белок, участвующий в процессах тканевого дыхания. Его применяют при асфиксии новорожденных, астматических состояниях, сердечной недостаточности, различных видах гепатита и т.п.
Рибонуклеазаи дезоксирибонуклеазавходят в состав глазных капель для лечения вирусных конъюнктивитов. При нанесении на рану они разжижают гной, при ингаляциях уменьшают вязкость слизи, деполимеризуя нуклеиновые кислоты в мокроте.
Трипсинингалируют при бронхолегочных заболеваниях для разжижения густой и вязкой мокроты.
Фициниспользуется в фармацевтической промышленности в качестве добавки к зубным пастам для удаления зубного налета.
Коллагеназуприменяют для ускорения отторжения некротизированных тканей, для очистки трофических язв.
Использование ферментов в медицинских технологиях
Специфичность ферментов к определенным субстратам широко нашла применение в настоящее время в лабораторной диагностике.
· многие лабораторные методы основаны на взаимодействии добавляемого извне фермента с определяемым соединением. В результате возникает специфичный продукт реакции, после определения содержания последнего судят о концентрации искомого вещества (глюкозооксидазный, холестеролоксидазныйметоды),
· иммуноферментныеметоды, основанные на образовании тройного комплекса фермент-антиген-антитело. Определяемое вещество не является субстратом фермента, но является антигеном. Фермент может присоединять этот антиген вблизи от активного центра. Если в среде есть антиген, то при добавлении антител и формировании тройного комплекса активность фермента изменяется. Активность фермента измеряют любым способом.
Использование ингибиторов ферментов
Весьма широко применяются в настоящее время ингибиторы протеаз (контрикал, гордокс) при панкреатитах – состояниях, когда происходит активирование пищеварительных ферментов в протоках и клетках поджелудочной железы.
Ингибиторы холинэстеразы (физостигмин, прозерин) приводят к накоплению нейромедиатора ацетилхолина в синапсах и показаны при миастении, двигательных и чувствительных нарушениях при невритах, радикулитах, психогенной импотенции.
Препараты, содержащие ингибиторы моноаминоксидазы (наком, мадопар), повышают выработку нейромедиаторов катехоламинов в ЦНС при лечении паркинсонизма. Подавление активности моноаминооксидазы (разрушающей катехоламины) сохраняет нормальную передачу сигналов в нервной системе.
Ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл и т.п.) используются как антигипертензивное средство и вызывают расширение периферических сосудов, уменьшение нагрузки на миокард, снижение артериального давления.
Аллопуринол – ингибитор ксантиноксидазы, фермента катаболизма пуринов, требуется для снижения образования мочевой кислоты и подавления развития гиперурикемии и подагры.
Ингибиторы гидроксиметилглутарил-SКоА-редуктазы (ловастатин, флувастатин, аторвастатин) применяются для снижения синтеза холестерола при атеросклерозе, заболеваниях сердечно-сосудистой системы, дислипопротеинемиях.
Ингибитор карбоангидразы (ацетазоламид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, алкалозах и горной болезни.
Существуют шесть классов ферментов
В 1961 г в Москве V Международный биохимический союз принял современную классификацию ферментов. В соответствии с этой классификацией все ферменты делятся:
· на классы– по типу катализируемой реакции,
· каждый класс подразделяется на подклассы– по природе атакуемой химической группы,
· подклассы делятся на подподклассы– по характеру атакуемой связи или по природе акцептора.
Выделяют 6 классов ферментов:
o I класс – Оксидоредуктазы(подробно)
o II класс – Трансферазы(подробно)
o III класс – Гидролазы(подробно)
o IV класс – Лиазы(подробно)
o V класс – Изомеразы(подробно)
o VI класс – Лигазы(подробно)
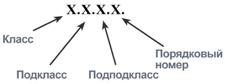
Каждому ферменту присвоен четырехзначный классификационный номер, включающий класс, подкласс, подподкласс и порядковый номер в подподклассе.
Например, алкогольдегидрогеназаимеет номер КФ 1.1.1.1. – это оксидоредуктаза, действует на ОН-группу донора с НАД в качестве акцептора с первым порядковым номером в своем подподклассе;лактатдегидрогеназа– КФ 1.1.1.27, действует на ОН-группу донора с НАД в качестве акцептора с порядковым номером 27 в своем подподклассе
Чтобы дать ферменту название существует два способа:
1. Систематическоеназвание – согласно современной классификации http://www.chem.qmul.ac.uk/iubmb/enzyme/. Часто такое название длинно и сложно для использования, поэтому как производное систематического названия у многих ферментов имеется одно или несколько рабочихназваний.
2. Тривиальноеназвание – название, сложившееся исторически. Например, пепсин, трипсин. Для некоторых ферментов (чаще для гидролаз) к названию субстрата добавляется окончание "-аза" – уреаза, амилаза, липаза. Тем не менее и у таких ферментов имеется систематическое название.
Оксидоредуктазы
Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры.
Наиболее распространены следующие рабочие названияоксидоредуктаз:
1. Дегидрогеназы– оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода.
2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами.
3. Оксидазы– оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата.
4. Монооксигеназы– оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
5. Диоксигеназы– оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
6. Пероксидазы– оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов.
Трансферазы
Трансферазы катализируют реакции переноса различных групп от одного субстрата (донор) к другому (акцептор), участвуют в реакциях взаимопревращения различных веществ, обезвреживания природных и чужеродных соединений. Коферментами являются пиридоксальфосфат,коэнзим А, тетрагидрофолиевая кислота, метилкобаламин. Класс подразделяется на 9 подклассов в зависимости от строения переносимых групп.
Примером подклассов являются ферменты, переносящие одноуглеродные фрагменты, альдегидные или кетоостатки, ацильные остатки, азотсодержащие группы, фосфорсодержащие группы.
Часто встречается рабочее название трансфераз – киназы. Это трансферазы, катализирующие перенос фосфата от АТФ на субстрат (моносахариды, белки и др), т.е. фосфотрансферазы.
Гидролазы
Гидролазы – ферменты, осуществляющие разрыв внутримолекулярных связей в субстрате (за исключением С-С связей) путем присоединения элементов Н2О, подразделяются на 13 подклассов. Ввиду сложности многих субстратов у ряда ферментов сохранены тривиальные названия, например, пепсин, трипсин. Коферменты отсутствуют.
Гидролазы широко представлены ферментами желудочно-кишечного тракта (пепсин, трипсин, липаза, амилаза и другие) и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры. Примером подклассов служат группы ферментов, действующие на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи.
Исторически названия гидролаз складывались из названия субстрата с окончанием "‑аза" – коллагеназа, амилаза, липаза, ДНК-аза. Наиболее часто встречаются следующие рабочие названия гидролаз:
1. Эстеразы– гидролиз сложноэфирных связей.
2. Липазы– гидролиз нейтральных жиров (триацилглицеролов).
3. Фосфатазы– гидролиз моноэфиров фосфорной кислоты.
4. Гликозидазы– гидролизуют О- и S-гликозидные связи.
5. Протеазы, пептидазы– гидролиз белков и пептидов.
6. Нуклеазы– гидролиз нуклеиновых кислот.
Лиазы
Лиазы – ферменты, катализирующие разрыв С-О, С-С, C-N и других связей, а также обратимые реакции отщепления различных групп негидролитическим путем. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт.
Примером подклассов являются ферменты, действующие на углерод-углеродные связи, углерод-кислородные связи, углерод-азотные связи.
Систематическое название образуется:
Расщепляемый субстрат : отделяемая группа – лиаза
Изомеразы
Изомеразы – ферменты, катализирующие изомерные превращения в пределах одной молекулы. Изомеразы – сложные ферменты. К их коферментам относятся пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов (глюкозо-1,6-дифосфат) и др.
Выделяют 6 подклассов изомераз в зависимости от типа реакции. Например, в первый подкласс выделяют рацемазы(обратимое превращение L- и D-стереоизомеров) и эпимеразы(превращения изомеров, имеющих более одного центра асимметрии, например, α-D-глюкозу в β-D-глюкозу).
Систематическое название образуется:
Субстрат – [ ] – реакция, где [ ] – обозначение, отражающее суть реакции, например, "номер изменяемого атома углерода", изменение "цис-транс", изменение "кето-енол", изменение "альдозо-кетозо".
Лигазы
Лигазы (синтетазы) – ферменты, катализирующие присоединение друг к другу двух молекул с использованием энергии высокоэнергетических связей АТФ (или других макроэргов). Лигазы – сложные ферменты. Они содержат нуклеотидные(УТФ), биотиновые(витамин Н), фолиевые коферменты. Выделяют 6 подклассов.
Систематическое название образуется:
Субстрат 1 : субстрат 2 – лигаза
