Номенклатура и свойства неорганических соединений.
Химия
Контрольные задания
для студентов-заочников,
обучающихся по направлениям
110900.62 –«Технология производства и переработки
сельскохозяйственной продукции», 110400.62 – «Агрономия»
Лесное дело»
Великий Новгород
2011 г
Химия: контрольные задания для студентов-заочников / Сост. Е.Н.Бойко, Н.Ю.Масовер – Великий Новгород: НовГУ, 2011.
Общие указания
Выполнение контрольной работы является необходимым этапом самостоятельной работы студента при изучении курса химии. Зачтенная преподавателем контрольная работа, наряду с зачтенными лабораторными работами, служит основанием для допуска к сдаче экзамена.
Вариант контрольного задания определяется двумя последними цифрами номера зачетной книжки.
Контрольная работа оформляется по следующим правилам:
- все задачи должны строго соответствовать варианту и быть представлены в последовательности, указанной в таблице вариантов;
- условия задач должны быть переписаны в тетрадь полностью;
- необходимо пользоваться современной химической номенклатурой;
- все физические величины должны быть выражены в единицах Международной системы (СИ)
- на каждой странице необходимо оставлять поля (1/4-1/5 страницы) для замечаний рецензента.
Выполненную контрольную работу студенты сдают либо своему преподавателю, либо лаборантам кафедры, либо в деканат. Получив проверенную работу, студент исправляет ошибки (если они есть) и делает необходимые дополнения (если это указано рецензентом), после чего следует очная защита работы.
Список рекомендуемой литературы
Основная:
1 Глинка Н.Л. Общая химия: Учеб. пособие для вузов/ Под ред. А.И. Ермакова. – 29-е изд., испр. – М.: Интеграл-Пресс, 2002. – 727с.
2 Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособие для студентов вузов/ Под ред. В.А. Рабиновича, Х.М. Рубиной. – Изд. испр. – М.: Интеграл-Пресс, 2002. – 240с.
3 Князев Д.А. Неорганическая химия: Учеб. для вузов по спец. «Агрохимия и почвоведение»/ Д.А. Князев, С.Н. Смарыгин. – М.: Высш. шк., 1990. - 430с.
4 Никольский А.Б. Химия: Учебник для вузов/ А.Б. Никольский, А.В. Суворов. – СПб: Химиздат, 2001. – 512с.
5. Коровин В.Н Общая химия. – М.: ВШ., 1998 (2002). - 559 с
Дополнительная:
1 Угай Я.А. Общая и неорганическая химия.- М.: ВШ, 1997, 527 с.
2 Хомченко Г.П., Цитович И.К. Неорганическая химия. - М.: ВШ, 1987, 464 с.
3 Князев Д.А., Смарыгин С.Н. Неорганическая химия, - М.: ВШ, 1990, 430 с.
4 Романцева Л.М., Лещинская З.Л., Суханова В.А..Сборник задач и упражнений по общей химии. - М.: ВШ, 1991, - 288 с.
5. Суворов А.В. Общая химия: Учеб. пособие для вузов/ А.В. Суворов, А.Б. Никольский. – СПб: Химия, 1995. - 624с.
6. Суворов А.В. Вопросы и задачи по общей химии/ А.В. Суворов, А.Б. Никольский. – СПб: Химиздат, 2002. – 304с.
7. Цитович И.К. Курс аналитической химии: Учебник.- 7-е изд., стер. – СПб: Лань, 2004. – 496с.
Список методических рекомендаций и методических указаний
1. Кузьмичева В.П., Пчёлина Е.А. Основные классы неорганических соединений. - НовГУ, Новгород, 2004. - 26 с.
2. Масовер Н. Ю. Самостоятельная работа по курсу «Химия»: Методические указания и контрольные задания – НовГУ,- Великий Новгород, 2006. - с.
3. Кузьмичева В.П., Летенкова И.В. Получение солей. – НовГУ, Новгород, 2004. – 14 с.
4. Олисова Г.Н., Ульянова Н.И. Концентрация растворов. Приготовление растворов заданной концентрации. – Новгород, НовГУ, 2006. – 14 с.
5. Кузьмичева В.П., Бойко Е.Н., Летенкова И.В. Электролитическая диссоциация. – НовГУ, Новгород, 2006. – 6 с.
6. Бойко Е.Н., Олисова Г. Н., Ульянова Н. И. Водородный показатель. – НовГУ, Новгород, 2006. – 6 с.
7. Литвинов В.Ф., Летенкова И.В. Гидролиз солей. – НовГУ, Новгород, 2006.– 12 с.
8. Бойко Е.Н., Олисова Г.Н., Ульянова Н.И. Окислительно-восстановительные реакции. - НовГУ, Новгород, 2006.- 38 с.
9.Летенкова И.В., Бойко Е.Н. Кинетика химических реакций: Методические указания, НовГУ, Новгород, 2006. -21 с.
10. Бойко Е.Н., Олисова Г.Н., Ульянова И.И. ОВР. Методические указания. НовГУ, Новгород, 2006. - 38 с.
11. Бойко Е.Н., Петухова Электрохимическая коррозия металлов. Методические указания/ - НовГУ, Новгород, 2006. - 17с.
12. Кузьмичева В.П., Олисова Г.Н., Ульянова И.И. Комплексные соединения. НовГУ, Новгород, 2006,- 15 с.
1 Контрольное задание №1
Характеристика химического элемента и его соединений
Дайте характеристику химического элемента, приведённого в вашем варианте задания, а также простых и сложных соединений, образуемых данным элементом. Варианты задания 2 представлены в таблице 3.
Таблица 3.
| Номер варианта | Химический элемент | Номер варианта | Химический элемент | Номер варианта | Химический элемент |
| Натрий Калий Магний Кальций Бор Алюминий Углерод Кремний Азот Фосфор | Сера Хлор Медь Цинк Хром Молибден Марганец Железо Кобальт Углерод | Азот Фосфор Калий Магний Бор Сера Медь Цинк Марганец Железо |
План характеристики химического элемента и его соединений.
1. Определите положение химического элемента в периодической системе (номер периода, номер группы, подгруппу) и семейство химических элементов, к которому он принадлежит (s, p,d,f-элемент).
2. Опишите строение атома химического элемента (в основном состоянии):
а) определите число протонов, нейтронов и электронов в атоме;
б) напишите полную электронную формулу и характеристическую электронную формулу химического элемента, приведите орбитальную диаграмму электронной оболочки атома;
в) приведите варианты распределения валентных электронов по орбиталям и укажите количество неспаренных электронов в возбуждённых состояниях атома, укажите характерные степени окисления элемента.
3. Опишите свойства простых веществ:
а) определите принадлежность простых веществ к металлам или неметаллам, приведите уравнения реакций, характеризующих свойства простых веществ.
4. Опишите свойства наиболее характерных сложных веществ:
а) водородных соединений: химические формулы, приведите уравнения реакций, характеризующие кислотно-основные и окислительно-восстановительные свойства;
б) оксидов и гидроксидов: химические формулы, химический характер, приведите уравнения реакций, характеризующие кислотно-основные и окислительно-восстановительные свойства;
в) солей: химические формулы, характерные свойства, способность к гидролизу (приведите уравнения реакций).
5. Охарактеризуйте способность элемента к комплексообразованию, приведите примеры комплексных соединений элемента.
6. Укажите распространённость элемента и формы нахождения его в природе.
7. Приведите способы получения наиболее важных соединений элемента.
8. Охарактеризуйте применение соединений элемента, значение элемента и его соединений.
3 Контрольное задание №3
Химическое равновесие.
Химическая система находится в замкнутом объеме в состоянии равновесия:
аА + bB ↔ сС + dD.
Определите направление смещения химического равновесия в системе, приведенной в вашем варианте задания, при изменении условий:
а) при понижении давления;
б) при уменьшении объема;
в) при уменьшении концентрации продуктов реакции;
г) при нагревании.
Укажите, как следует изменить температуру и давление (повысить или понизить), чтобы смещение равновесия привело к повышению выхода продуктов реакции. Все ответы поясните.
Варианты задания4.3 приведены в таблице 7.
Таблица 7.
| Номер варианта | Уравнение обратимой реакции аА + bB ↔ сС + dD |
| 4NH3(г)+5O2(г)=4NO(г)+6H2O(г); ΔH<0 | |
| 2CO(г)+O2(г)=2CO2(г); ΔH<0 | |
| PCl5(г)=PCl3(г)+Cl2(г); ΔH>0 | |
| 2SO2(г)+O2(г)=2SO3(г); ΔH<0 | |
| C(к)+H2O(г)=CO(г)+H2(г); ΔH>0 | |
| C3H8(г)=C2H4(г)+CH4(г); ΔH>0 | |
| N2(г)+3H2(г)=2NH3(г); ΔH<0 | |
| 2NO(г)+Cl2(г)=2NOCl(г); ΔH<0 | |
| N2(г)+O2(г)=2NO(г); ΔH>0 | |
| 2CO(г)=CO2(г)+C(к); ΔH<0 | |
| 2H2S(г)=2H2(г)+S2(г); ΔH>0 | |
| CO(г)+2H2(г)=CH3OH(г); ΔH>0 | |
| H2(г)+Br2(г)=2HBr(г); ΔH<0 | |
| 4HCl(г)+O2(г)=2H2O(г)+2Cl2(г); ΔH<0 | |
| CO(г)+H2O(г)=CO2(г)+H2(г); ΔH<0 | |
| C(к)+O2(г)=CO2(г); ΔH<0 | |
| 2H2O(г)=2H2(г)+O2(г); ΔH>0 | |
| COCl2(г)=CO(г)+Cl2(г); ΔH>0 | |
| 2NO(г)+O2(г)=2NO2(г); ΔH<0 | |
| MgCO3(к)=MgO(к)+CO2(г); ΔH>0 | |
| VO(к)+H2(г)=V(к)+H2O(г); ΔH>0 | |
| 2C(к)+O2(г)=2CO(г); ΔH<0 | |
| C(к)+2N2O(г)=CO2(г)+2N2(г); ΔH<0 | |
| P4(к)+6Cl2(г)=4PCl3(ж); ΔH<0 | |
| PCl3(ж)+Cl2(г)=PCl5(к); ΔH<0 | |
| 2CH3OH(ж)+3O2(г)=CO2(г)+2H2O(ж); ΔH<0 | |
| 2CH4(г)+O2(г)=2CO(г)+4H2(г); ΔH<0 | |
| N2H4(ж)+O2(г)=N2(г)+2H2O(ж); ΔH<0 | |
| SiO2(к)+2C(к)+2Cl2(г)=SiCl4(г)+2CO(г); ΔH<0 | |
| SiH4(г)+2O2(г)=SiO2(к)+2H2O(г); ΔH<0 |
5 Контрольное задание №5
Комплексные соединения
В водных растворах при 298К
| Электрод | 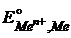 ,B ,B | Электрод | 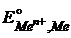 ,B ,B | Электрод | 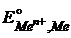 ,B ,B |
| Li+, Li | -3,045 | A13+, Al | -1,662 | Ni2+, Ni | -0,250 |
| Rb+,Rb | -2,925 | Mn2+, Mn | -1,180 | Sn2+, Sn | -0,136 |
| К+,К | -2,925 | Cr2+, Cr | -0,913 | Pb2+, Pb | -0,126 |
| Cs+, Cs | -2,923 | Zn2+, Zn | -0,763 | Fe3+, Fe | -0,036 |
| Ra2+, Ra | -2,916 | Cr3+, Cr | -0,740 | H+,H2 | 0,000 |
| Ba2+, Ba | -2,906 | Fe2+, Fe | -0,440 | Bi3+,Bi | +0,215 |
| Ca2+, Ca | -2,866 | Cd2+, Cd | -0,403 | Cu2+, Cu | +0,337 |
| Na+, Na | -2,714 | In3+,In | -0,343 | Ag+, Ag | +0,799 |
| Mg2+, Mg | -2,363 | Tl+, Tl | -0,336 | Hg2+, Hg | +0,854 |
| Be2+, Be | -1,850 | Co2+, Co | -0,277 | Au3+,Au | +1,498 |
Приложение Д.
Общие константы нестойкости некоторых комплексных ионов
в водных растворах при 25°С.
| Комплексный ион | Кн | Комплексный ион | Кн |
| [Ag(CN)3]2- [Ag(S2O3)2]3- [Ag(NH3)2]+ [Ag(NO2)2]- [AlF6]3- [Cd(CN)4]2- [Cd(NH3)4]2+ [Cu(CN)4]2- [Co(NH3)4]2+ [Ni(NH3)2]2+ [Ni(NH3)4]2+ [PbCl4]2- [PbBr4]2- [Pb(S2O3)4]6- | 2,80*10-21 3,47*10-14 9,3·10-8 1,5·10-3 1,48*10-21 7,76*10-18 2,8·10-7 5,00*10-28 2,8·10-7 1,9·10-9 3,4·10-8; 1,0·10-16 3,16·10-21 6,31·10-8 | [Fe(CN)6]4- [Fe(CN)6]3- [Hg(CN)4]2- [Hg(SCN)4]2- [HgCl4]2- [HgI4]2- [HgBr4]2- [Zn(CN)4]2- [Zn(OH)4]2- [Zn(NH3)4]2+ [BiCl6]3- [BiI6]3- [Bi(SCN)6]3- | 1,26*10-37 1,26*10-44 4,0·10-42 5,9·10-22 6,03*10-16 1,48*10-30 1,0·10-21 2,40*10-20 3,6·10-16 3,46·10-10 3,8·10-7 7,94·10-20 5,89·10-5 |
Химия
Контрольные задания
для студентов-заочников,
обучающихся по направлениям
110900.62 –«Технология производства и переработки
сельскохозяйственной продукции», 110400.62 – «Агрономия»
Лесное дело»
Великий Новгород
2011 г
Химия: контрольные задания для студентов-заочников / Сост. Е.Н.Бойко, Н.Ю.Масовер – Великий Новгород: НовГУ, 2011.
Общие указания
Выполнение контрольной работы является необходимым этапом самостоятельной работы студента при изучении курса химии. Зачтенная преподавателем контрольная работа, наряду с зачтенными лабораторными работами, служит основанием для допуска к сдаче экзамена.
Вариант контрольного задания определяется двумя последними цифрами номера зачетной книжки.
Контрольная работа оформляется по следующим правилам:
- все задачи должны строго соответствовать варианту и быть представлены в последовательности, указанной в таблице вариантов;
- условия задач должны быть переписаны в тетрадь полностью;
- необходимо пользоваться современной химической номенклатурой;
- все физические величины должны быть выражены в единицах Международной системы (СИ)
- на каждой странице необходимо оставлять поля (1/4-1/5 страницы) для замечаний рецензента.
Выполненную контрольную работу студенты сдают либо своему преподавателю, либо лаборантам кафедры, либо в деканат. Получив проверенную работу, студент исправляет ошибки (если они есть) и делает необходимые дополнения (если это указано рецензентом), после чего следует очная защита работы.
Список рекомендуемой литературы
Основная:
1 Глинка Н.Л. Общая химия: Учеб. пособие для вузов/ Под ред. А.И. Ермакова. – 29-е изд., испр. – М.: Интеграл-Пресс, 2002. – 727с.
2 Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособие для студентов вузов/ Под ред. В.А. Рабиновича, Х.М. Рубиной. – Изд. испр. – М.: Интеграл-Пресс, 2002. – 240с.
3 Князев Д.А. Неорганическая химия: Учеб. для вузов по спец. «Агрохимия и почвоведение»/ Д.А. Князев, С.Н. Смарыгин. – М.: Высш. шк., 1990. - 430с.
4 Никольский А.Б. Химия: Учебник для вузов/ А.Б. Никольский, А.В. Суворов. – СПб: Химиздат, 2001. – 512с.
5. Коровин В.Н Общая химия. – М.: ВШ., 1998 (2002). - 559 с
Дополнительная:
1 Угай Я.А. Общая и неорганическая химия.- М.: ВШ, 1997, 527 с.
2 Хомченко Г.П., Цитович И.К. Неорганическая химия. - М.: ВШ, 1987, 464 с.
3 Князев Д.А., Смарыгин С.Н. Неорганическая химия, - М.: ВШ, 1990, 430 с.
4 Романцева Л.М., Лещинская З.Л., Суханова В.А..Сборник задач и упражнений по общей химии. - М.: ВШ, 1991, - 288 с.
5. Суворов А.В. Общая химия: Учеб. пособие для вузов/ А.В. Суворов, А.Б. Никольский. – СПб: Химия, 1995. - 624с.
6. Суворов А.В. Вопросы и задачи по общей химии/ А.В. Суворов, А.Б. Никольский. – СПб: Химиздат, 2002. – 304с.
7. Цитович И.К. Курс аналитической химии: Учебник.- 7-е изд., стер. – СПб: Лань, 2004. – 496с.
Список методических рекомендаций и методических указаний
1. Кузьмичева В.П., Пчёлина Е.А. Основные классы неорганических соединений. - НовГУ, Новгород, 2004. - 26 с.
2. Масовер Н. Ю. Самостоятельная работа по курсу «Химия»: Методические указания и контрольные задания – НовГУ,- Великий Новгород, 2006. - с.
3. Кузьмичева В.П., Летенкова И.В. Получение солей. – НовГУ, Новгород, 2004. – 14 с.
4. Олисова Г.Н., Ульянова Н.И. Концентрация растворов. Приготовление растворов заданной концентрации. – Новгород, НовГУ, 2006. – 14 с.
5. Кузьмичева В.П., Бойко Е.Н., Летенкова И.В. Электролитическая диссоциация. – НовГУ, Новгород, 2006. – 6 с.
6. Бойко Е.Н., Олисова Г. Н., Ульянова Н. И. Водородный показатель. – НовГУ, Новгород, 2006. – 6 с.
7. Литвинов В.Ф., Летенкова И.В. Гидролиз солей. – НовГУ, Новгород, 2006.– 12 с.
8. Бойко Е.Н., Олисова Г.Н., Ульянова Н.И. Окислительно-восстановительные реакции. - НовГУ, Новгород, 2006.- 38 с.
9.Летенкова И.В., Бойко Е.Н. Кинетика химических реакций: Методические указания, НовГУ, Новгород, 2006. -21 с.
10. Бойко Е.Н., Олисова Г.Н., Ульянова И.И. ОВР. Методические указания. НовГУ, Новгород, 2006. - 38 с.
11. Бойко Е.Н., Петухова Электрохимическая коррозия металлов. Методические указания/ - НовГУ, Новгород, 2006. - 17с.
12. Кузьмичева В.П., Олисова Г.Н., Ульянова И.И. Комплексные соединения. НовГУ, Новгород, 2006,- 15 с.
1 Контрольное задание №1
Номенклатура и свойства неорганических соединений.
1.1 Химическая классификация и номенклатура неорганических соединений
Используя химические элементы, приведенные в вашем варианте задания составьте химические формулы всех возможных оксидов, гидроксидов (основных, кислотных, амфотерных) и выполните следующие задания:
а) назовите и классифицируйте полученные соединения;
б) составьте уравнения всех возможных реакций взаимодействия полученных оксидов с серной кислотой ;
в) составьте уравнения всех возможных реакций взаимодействия полученных оксидов с гидроксидом калия.
Варианты задания 1.1 представлены в таблице 1.
Таблица 1.
| Номер варианта | Названия элементов с указанием степени окисления | ||
| Литий | Кремний (IV) | Хром (III) | |
| Висмут (III) | Азот (V) | Цинк | |
| Таллий (I) | Азот (III) | Медь (II) | |
| Барий | Углерод (IV) | Скандий (III) | |
| Стронций | Фосфор (V) | Железо (III) | |
| Кальций | Мышьяк (V) | Титан (IV) | |
| Магний | Сера (IV) | Хром (III) | |
| Натрий | Сера (VI) | Цинк | |
| Бериллий | Сурьма (V) | Ванадий (II) | |
| Сурьма (III) | Селен (IV) | Хром (II) | |
| Алюминий | Селен (VI) | Железо (II) | |
| Галлий (III) | Хлор (V) | Кобальт (II) | |
| Германий (IV) | Хлор (VII) | Никель (II) | |
| Олово (II) | Йод (V) | Иттрий (III) | |
| Свинец (II) | Бром (V) | Лантан (III) | |
| Литий | Бор | Медь (II) | |
| Висмут (III) | Кремний (IV) | Скандий (III) | |
| Таллий (I) | Азот (V) | Железо (III) | |
| Барий | Азот (III) | Титан (IV) | |
| Строций | Углерод (IV) | Хром (III) | |
| Кальций | Фосфор (V) | Цинк | |
| Магний | Мышьяк (М) | Медь (II) | |
| Натрий | Сера (IV) | Скандий (III) | |
| Бериллий | Сера (VI) | Лантан (III) | |
| Сурьма (III) | Селен (VI) | Никель (II) | |
| Алюминий | Сурьма (V) | Кобальт (II) | |
| Галлий (III) | Селен (IV) | Железо (II) | |
| Германий (IV) | Хлор (V) | Хром (II) | |
| Олово (II) | Хлор (VII) | Ванадий (II) | |
| Свинец (II) | Йод (V) | Лантан (III) |
1.2 Генетическая связь между отдельными классами неорганических соединений
Напишите уравнения реакций, при помощи которых можно осуществить приведеные превращения. Укажите (при необходимости) условия протекания этих реакций. Назовите каждое из приведенных соединений.
Варианты задания 1.2 представлены в таблице 2.
Таблица 2.
| Номер варианта | «Цепочка» превращений |
| Fe → Fe2O3 → Fe(NO3)3 → Fe(OH)3 → Fe2O3 →Fe | |
| Al2O3 → KAlO2 → Al(OH)3 → Al2O3 → Al → AlI3 | |
| CH4 → СO2 → CaCO3 → Ca(HCO3)2 → CO2 → CO | |
| SiO2 → Na2SiO3 → H2SiO3 → SiO2 → Si → Mg2Si | |
| Ca3(PO4)2 → P4 → H3PO4 → Ca(H2PO4)2 → Ca3(PO4)2 | |
| P → P2O5 → H3PO4 → Na2HPO4 → Na3PO4 → Ag3PO4 | |
| KHSO3 → K2SO3 → K2SO4 → K2S → H2S → S | |
| Al → AlCl3 → Al(OH)3 → Al(NO3)3 → Al2O3 → KAlO2 | |
| Fe(NO3)2 → FeO → Fe → FeCl3 → Fe(OH)3 → Fe(NO3)3 | |
| FeCO3 → FeO → FeCl2 → FeCl3 → Fe(NO3)3 → Fe2O3 | |
| Si → K2SiO3 → SiO2 → Si → SiO2 → K2SiO3 | |
| NH3 → NO → NO2 → HNO3 → NH4NO3 → N2O | |
| S → H2S → SO2 → SO3 → H2SO4 → Na2SO4 | |
| Ca → CaO → Ca(OH)2 → Ca(NO3)2 → Ca3(PO4)2 → H3PO4 | |
| Ba → BaO → BaCO3 → Ba(HCO3)2 → BaCO3 → (BaOH)2CO3 | |
| Cu → CuSO4 → (CuOH)2SO4 → Cu(OH)2 → Na2[Cu(OH)4] | |
| Al →Al2(SO4)3→Al(NO3)3→Al(OH)2NO3→Al(OH)3→ Na3[Al(OH)6] | |
| FeS → H2S → S → SO2 → NaHSO3 → Na2SO3 | |
| H2SO4 → SO2 → SO3 → MgSO4 → PbSO4 → Pb(HSO4)2(p) | |
| H2O → H2 → NH3 → NH4Cl → NH4NO3 → N2 | |
| Ca3(PO4)2 → P → AlP → PH3 → H3PO4 → Ca3(PO4)2 | |
| Pb → Pb(NO3)2 → Pb(OH)2 → Na2[Pb(OH)4] → Pb(OH)2 → PbO | |
| Cu → CuO → Cu → Cu(NO3)2 → CuO → CuSO4 | |
| Zn → ZnO → ZnI2 → Na2[Zn(OH)4] → Zn(OH)2 → ZnO | |
| Cr → CrCl2 → Cr(OH)2 → Cr(OH)3 → Cr(NO3)3 → Cr2O3 | |
| Cr → Cr(NO3)3 → Cr(OH)3 → Na3[Cr(OH)6] → Cr(OH)3 → CrCl3 | |
| Mn → MnSO4 → Mn(OH)2 → MnO(OH) → MnO2 → MnCl2 | |
| Fe → Fe(OH)2 → Fe(OH)3 → Fe3O4 → Fe(NO3)3 → Fe2O3 | |
| Fe → FeCl2 → FeCl3 → Fe(OH)3 → K2FeO4 → Fe(OH)3 | |
| FeS2 → Fe2O3 → Fe3O4 → FeO → Fe → FeCl3 |
2. Контрольное задание №2
