Некоторые свойства неорганических соединений
Свойства оксидов и гидроксидов
1. Отношение к воде.
Из оснóвных оксидов с водой взаимодействуют только оксиды щелочных (Li, Na, K, Rb, Cs) и щелочноземельных (Ca, Sr, Ba) металлов, при этом образуются растворимые в воде основания щёлочи:
Na2O + H2O = 2NaOH
СaO + H2O = Сa(OH)2
Большинство кислотных оксидов взаимодействуют с водой (исключение, например - SiO2 и соответствующая кислота H2SiO3 ), образуя растворимые в воде кислоты (кислотные гидроксиды):
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
Все амфотерные гидроксиды в воде нерастворимы.
2. Кислотно-основные взаимодействия.
Оксиды и гидроксиды с противоположными (кислотными и основными) свойствами реагируют между собой.
Оснóвные оксиды и гидроксиды взаимодействуют с кислотными оксидами и кислотами:
K2O + SO2 = K2SO3
2KOH + SO2 = K2SO3 + H2O
MgO + H2CO3 = MgCO3 + H2O
Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
а также с амфотерными оксидами и гидроксидами (в этом случае амфотерные соединения проявляют кислотные свойства, и формулы соответствующих гид-
роксидов лучше записывать в виде кислот):
K2O + BeO = K2BeO2
K2O + Be(OH)2 (или H2BeO2) = K2BeO2 + H2O
6NaOH + Al2O3 = 2Na3AlO3 + 3H2O
3NaOH + Al(OH )3 (или H3AlO3) = Na3AlO3 + 3H2O
Кислотные оксиды и кислоты реагируют с оснóвными оксидами и гидроксидами, а также с амфотерными оксидами и гидроксидами (в этом случае амфотерные соединения проявляют оснóвные свойства):
N2O5 + ZnO = Zn(NO3)2
SO3 + Zn(OH)2 = ZnSO4 + H2O
2HNO3 + ZnO = Zn(NO3)2 + H2O
H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O
3. Взаимодействие с солями.
Кислоты и щелочи реагируют с солями, если в результате образуются слабые электролиты, малорастворимые, газообразные вещества:
2KOH + FeSO4 = Fe(OH)2¯ + K2SO4
H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2
Свойства солей
Средние соли вступают в реакции обмена со щелочами, кислотами, (примеры соответствующих реакций см. выше), солями, если в результате образуется малорастворимая соль:
3MgCl2 + 2Na3PO4 = Mg3(PO4)2¯ + 6NaCl
Кислые соли образуются кислотами, у которых два или более катионов водорода. Получают эти соли взаимодействием основания с избытком кислоты или кислотного оксида:
Ca(OH)2 + 2H3PO4 = CaHPO4 + 2H2O
NaOH + CO2 = NaHCO3
а также взаимодействием средней соли и соответствующей или более сильной кислоты, взятой в недостатке:
CaCO3 + H2CO3 = Ca(HCO3)2
Na3PO4 + HCl = Na2HPO4 + NaCl
Оснóвные соли образуют слабые основания или амфотерные гидроксиды, у которых две или более гидроксогрупп. Получают эти соли взаимодействием оснований с недостатком кислоты:
Ni(OH)2 + HNO3 = NiOHNO3 + H2O
либо взаимодействием соответствующей средней соли и недостатка щелочи:
MgCl2 + NaOH = MgOHCl + NaCl
Кислые и основные соли обладают всеми свойствами средних солей. В реакциях со щелочами кислые соли, а с кислотами - оснóвные соли переходят в средние:
Ca(HCO3)2 + Сa(OH)2 = 2CaCO3 + 2H2O
NiOHNO3 + HNO3 = Ni(NO3)2 + H2O
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Основные понятия
Химические реакции сопровождаются энергетическими эффектами: выделением или поглощением тепла, света, совершением механической или электрической работы. Энергетические эффекты химических реакций изучает химическая термодинамика.В курсе химии рассмотрим только некоторые положения химической термодинамики.
Объектами изучения химической термодинамики являются разнообразные системы. Система– мысленно или реально выделенная часть пространства, содержащая одно или несколько веществ. Фаза – часть системы, одинаковая по физическим и химическим свойствам во всех точках и отделенная от других частей системы поверхностью раздела.
Для описания систем применяют сложный математический аппарат, в котором используют набор термодинамических функций, основные из которых: 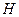 – энтальпия,
– энтальпия, 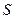 – энтропия,
– энтропия, 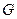 – энергия Гиббса. В пределах данного курса будем приводить значения функций только для стандартных условий.
– энергия Гиббса. В пределах данного курса будем приводить значения функций только для стандартных условий.
· Стандартные условияозначают, что все участвующие в реакции вещества чистые, парциальные давления газов или атмосферное давление, если газы не участвуют в реакции, равно 1,013 · 105 Па, концентрации частиц для реакций в растворах равны 1 моль/л, температура - 298 К. Термодинамические величины, определённые для стандартных условий, обозначают нулём в верхнем правом углу (например, S0).
