Определение равновесной степени превращения и равновесного состава
Уравнение KN = f(х*) нелинейное относительно х* и может иметь несколько решений, но всегда существует только одно, имеющее физический смысл значение х* , лежащее в интервале 1 ³ Х ³ 0.
Чаще всего значение х* определяется численным поиском. Уравнение функциональной зависимости KN = f(х*) можно записать:
F = KN - f(х*) = 0 (12)
Задача заключается в подборе такого значения х*, которое бы обращало уравнение (12) в тождество.
После определения х* рассчитывают ni и Ni (см. табл. 1).
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.
Выполнение лабораторной работы проводится каждым студентом самостоятельно. Вариант задания студент выбирает по указанию преподавателя из табл.2.
Выполнение лабораторной работы включает:
1. Сдачу коллоквиума.
2.Подготовку исходных данных. Для выбранной реакции необходимо:
а) составить зависимость константы равновесия от температуры, используя зависимость:
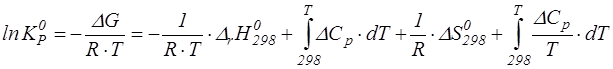
и сравнить ее с приведенной в приложении.
б) установить функциональную связь константы равновесия KN от равновесной степени превращения KN = f(х*).
в) получить у преподавателя задание по лабораторной работе (влияние каких параметров и в каких пределах необходимо учитывать).
г) ввести в программу выведенное уравнение расчета константы равновесия. Провести расчет, построить зависимости Кр, КN, Xp от изменяемых параметров.
д) Сделать анализ полученных данных. Определить оптимальные условия проведения процесса.
Таблица 2. Варианты заданий и исходные данные
| Номер варианта | Реакция | Температура, 0С | Давление, МПа | Соотноше-ние nE0/nA0 | Инертный разбавитель |
| 1. | CH4 + H2O <===> CO + 3H2 | 900(100¸2000) | 2(0,1¸4) | 1/(1¸4) | 0/(0¸4) |
| 2. | СО + H2O <===> CO2 + H2 | 700(100¸2000) | 2(0,1¸4) | 1/(1¸4) | 0/(0¸4) |
| 3. | 1/2N2 + 3/2H2 <===> NH3 | 800(100¸2000) | 30(5¸100) | 1/(1¸4) | 0/(0¸4) |
| 4. | СО2 + 4H2 <===> СH4 + 2H2O | 600(100¸1500) | 2(0,1¸4) | 1/(1¸4) | 0/(0¸4) |
| 5. | CO + 3H2 <===> CH4 + H2O | 600(100¸1500) | 2(0,1¸4) | 1/(1¸4) | 0/(0¸4) |
| 6. | 4NH3 + 5O2 <===> 4NO + 6H2O | 1000(100¸2000) | 0,1(0,1¸2) | 1/(1¸4) | 0/(0¸4) |
| 7. | 4NH3 + 3O2 <===> 2N2 + 6H2O | 2000(100¸2000) | 0,1(0,1¸2) | 1/(1¸4) | 0/(0¸4) |
| 8. | 2NO + O2 <===> 2NO2 | 700(100¸1500) | 0,5(0,1¸2) | 1/(1¸4) | 0/(0¸4) |
| 9. | 2NO2 <===> N2O4 | 500(100¸1000) | 1(0,1¸4) | 1/(1¸4) | 0/(0¸4) |
| 10. | 2SO2 + O2 <===> 2SO3 | 800(100¸2000) | 0,2(0,1¸2) | 1/(1¸4) | 0/(0¸4) |
| 11. | СH4 + 2H2O <===> СО2 + 4H2 | 900(100¸2000) | 0,2(0,1¸4) | 1/(1¸4) | 0/(0¸4) |
| 12. | NH3 <===> 1/2N2 + 3/2H2 | 800(100¸2000) | 1(0,1¸30) | 1/(1¸4) | 0/(0¸4) |
| 13. | 4NO + 6H2O <===> 4NH3 + 5O2 | 1000(100¸2000) | 0,1(0,1¸2) | 1/(1¸4) | 0/(0¸4) |
| 14. | 2SO3 <===> 2SO2 + O2 | 1000(100¸2000) | 0,1(0,1¸2) | 1/(1¸4) | 0/(0¸4) |
| 15. | S2 + 4CO2 <===> 2SO2 + 4CO | 900(100¸2000) | 0,1(0,1¸1) | 1/(1¸4) | 0/(0¸4) |
| 16. | S2 + 4H2O <===> 2SO2 + 4H2 | 1000(100¸2000) | 0,1(0,1¸1) | 1/(1¸4) | 0/(0¸4) |
| 17. | CH3OH <===> CO + 2H2 | 700(100¸1000) | 1(0,1¸30) | 1/(1¸4) | 0/(0¸4) |
| 18. | 2H2O(ж) <===> 2H2 + O2 | 400(100¸1000) | 2(1¸6) | 1/(1¸4) | 0/(0¸4) |
| 19. | C2H4 + H2O <===> C2H5OH | 550(100¸1000) | 8(1¸20) | 1/(1¸4) | 0/(0¸4) |
| 20. | 2C + 2H2 <===> C2H4 | 1000(100¸2000) | 1(0,1¸30) | 1/(1¸4) | 0/(0¸4) |
| 21. | 2SO2 + 4H2 <===> S2 + 4H2O | 1000(100¸2000) | 1(0,1¸30) | 1/(1¸4) | 0/(0¸4) |
| 22. | CH4 + CO2 <===> 2CO + 2H2 | 600(100¸1000) | 0,2(0,1¸10) | 1/(1¸4) | 0/(0¸4) |
| 23. | CO + 2H2 <===> CH3OH | 640(100¸1000) | 34,5(1¸100) | 1/(1¸4) | 0/(0¸4) |
| 24. | 2CO + 2H2<===> CH4 + CO2 | 200(100¸1000) | 0,2(0,1¸10) | 1/(1¸4) | 0/(0¸4) |
| 25. | 2H2 + O2 <===> 2H2O(ж) | 400(100¸1000) | 2(1¸6) | 1/(1¸4) | 0/(0¸4) |
ВОПРОСЫ К КОЛЛОКВИУМУ
1. Условия химического равновесия и показатели, характеризующие равновесие.
2. Кинетический вывод уравнения константы равновесия для газофазных реакций.
3. Способы выражения константы равновесия. Связь между Кр, Кс, КN.
4. Выражение константы равновесия для реальных газов. Фугитивность, коэффициент фугитивности.
5. Методика расчета равновесия для гетерогенных реакций.
6. Факторы, влияющие на состояние равновесия. Принцип Ле-Шателье.
7. Влияние Т на константу равновесия. Изотерма Вант-Гоффа.
8. Влияние Р и Сi на равновесную степень превращения. Способы смещения равновесия.
9. Расчет равновесной степени превращения.
9.1. Методы расчета G.
9.2. Установление функциональной зависимости КN = f(Хр)
9.3. Расчет Хр и равновесного состава.
ЛИТЕРАТУРА
1. Позин М.Е., Зинюк Р.Ю. Физико-химические основы неорганической технологии. - СПб.: Химия, 1993. - 440с.
2. Рэмсден Э. Н. Начала современной химии: Справ, изд.: перевод с англ./Под ред. В. И. Барановского, А. А. Белюстина, А. И. Ефимова, А. А. Потехина. - Л.: Химия, 1989, – 784 с., ил.
3. Расчеты химико–технологических процессов. Под ред. Мухленова И.П. Л.: Химия, 1976.
4. Карапетьянц М.Х. Введение в теорию химических процессов: Учеб. Пособие для вузов.– М.: Высш. школа, 1981.– 333 с., ил.
ПРИЛОЖЕНИЕ 1
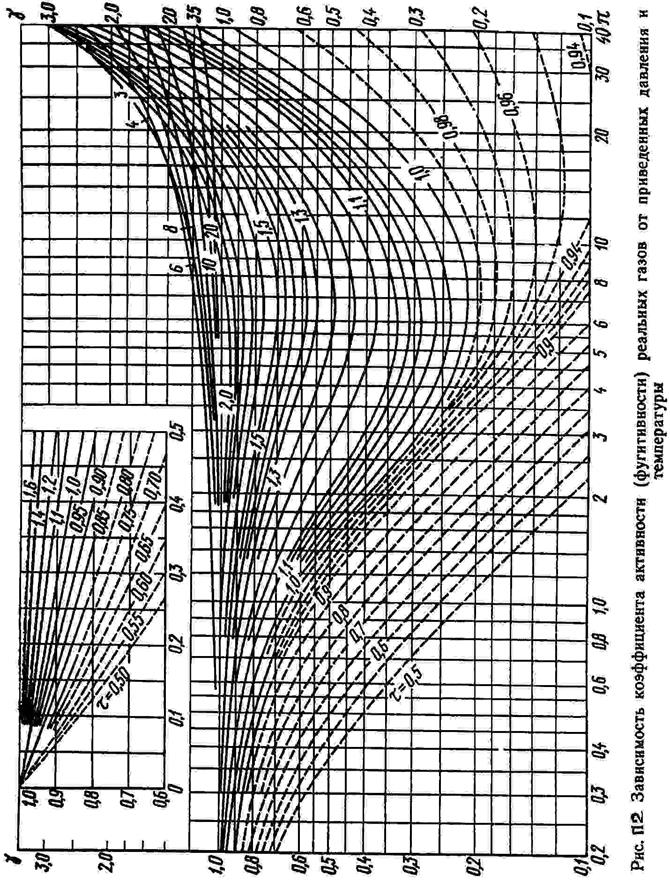 |
 |
 ПРИЛОЖЕНИЕ 2
ПРИЛОЖЕНИЕ 2
Таблица 3 Константы равновесия реакций при Р = 101325 Па
| Номер Вар. | Реакция | Выражение константы |
| 1. | CH4 + H2O <===> CO + 3H2 | lg Kp = -9874/T + 7.14×lgT – 1.88×10-3’ T + 0.094×10-6 ×T2 – 8.64 |
| 2. | СО + H2O <===> CO2 + H2 | lg Kp = 2203.24/T + 5.1588×10-5 ×T + 2.5426×10-7 ×T2 – 7.4617×10-11 ×T3 – 2.3 |
| 3. | 1/2N2 + 3/2H2 <===> NH3 | lg Kp = 2074.8/T – 2.4943×lgT – 1.256×10-4 ×T + 1.8564×10-7 ×T2 + 2.206 |
| 4. | СО2 + 4H2 <===> СH4 + 2H2O | 1/lg Kp = –7674/T + 6.23×lgT + 0. 906×10-3 ×T + 0.0546×10-6 ×T2 – 8.72 |
| 5. | CO + 3H2 <===> CH4 + H2O | 1/ lg Kp = -9874/T + 7.14×lgT – 1.88×10-3 ×T + 0.094×10-6 ×T2 – 0.64 |
| 6. | 4NH3 + 5O2 <===> 4NO + 6H2O | lg Kp = -47500/T - 1.75×lgT – 8.4 |
| 7. | 4NH3 + 3O2 <===> 2N2 + 6H2O | lg Kp = -66250/T - 1.75×lgT – 5.2 |
| 8. | 2NO + O2 <===> 2NO2 | lg Kp = 5749/T - 1.70×lgT + 5×10-4 ×T – 2.839 |
| 9. | 2NO2 <===> N2O4 | lg Kp = 2692/T – 1.75×lgT – 4.83×10-3×T + 7.144×10-6 ×T2 – 3.82 |
| 10. | 2SO2 + O2 <===> 2SO3 | lg Kp = 4812.2/T – 2.8254×lgT + 2.284×10-3×T – 7.012×10-7 ×Т2 + 1.197×10-10× T3 + 2.23 |
| 11. | СH4 + 2H2O <===> СО2 + 4H2 |   lg Kp = –7674/T + 6.23×lgT + 0. 906×10-3 ×T + 0.0546×10-6 ×T2 – 8.72 lg Kp = –7674/T + 6.23×lgT + 0. 906×10-3 ×T + 0.0546×10-6 ×T2 – 8.72 |
| 12. | NH3 <===> 1/2N2 + 3/2H2 | 1/lg Kp = 2074.8/T – 2.4943×lgT – 1.256×10-4 ×T + 1.8564×10-7 ×T2 + 2.206 |
| 13. | 4NO + 6H2O <===> 4NH3 + 5O2 | 1/lg Kp = -47500/T - 1.75×lgT – 8.4 |
| 14. | 2SO3 <===> 2SO2 + O2 | 1/lg Kp = 4812.2/T – 2.8254×lgT + 2.284×10-3×T – 7.012×10-7 ×Т2 + 1.197×10-10× T3 + 2.23 |
| 15. | S2 + 4CO2 <===> 2SO2 + 4CO | 1/lg Kp = -23000/T + 4.34×lgT – 1.62×10-3×T + 20.23×10-6 ×Т2 – 2.43 |
| 16. | S2 + 4H2O <===> 2SO2 + 4H2 | 1/lg Kp = -1380/T – 0.877×lgT + 2.67×10-3 ×T – 0.46×10-6 ×T2 + 3.38 |
| 17. | CH3OH <===> CO + 2H2 | 1/lg Kp = 3921/T - 7.971×lgT + 2.5×10-3 ×T – 2.953×10-7 ×T2 + 10.2 |
| 18. | 2H2O(ж) <===> 2H2 + O2 | 1/lg Kc = 24900/T– 1.335×lgT + 9.65×10-5×T– 1.37×10-7 ×Т2 + 6.65×10-11× T3 –1.907×10-18× T5 + 1.08 |
| 19. | C2H4 + H2O <===> C2H5OH | lg K p = 2093/T – 6.304 + (103/T – 62.5×103/T2) |
| 20. | 2C + 2H2 <===> C2H4 | lg Kp = - 4533.3/T + 0.6446×lgT + 0.8646×10-3×T + 0.1814×10-6 ×Т2 + 2.336 |
| 21. | 2SO2 + 4H2 <===> S2 + 4H2O | lg Kp = -1380/T – 0.877×lgT + 2.67×10-3 ×T – 0.46×10-6 ×T2 + 3.38 |
| 22. | CH4 + CO2 <===> 2CO + 2H2 | lg Kp = -11087.7/T + 3.1127×lgT – 2.8524×10-3 ×T + 13.216×10-6 ×T2 – 8.528 |
| 23. | CO + 2H2 <===> CH3OH | lg Kp = 3921/T - 7.971×lgT + 2.5×10-3 ×T – 2.953×10-7 ×T2 + 10.2 |
| 24. | 2CO + 2H2<===> CH4 + CO2 | 1/lg Kp = -11087.7/T + 3.1127×lgT – 2.8524×10-3 ×T + 13.216×10-6 ×T2 – 8.528 |
| 25. | 2H2 + O2 <===> 2H2O(ж) | lg Kc = 24900/T – 1.335×lgT + 9.65×10-5×T – 1.37×10-7 ×Т2 + 6.65×10-11× T3 – 1.907×10-18× T5 + 1.08 |
