Химические свойства оснований
Закон постоянства состава вещества
Всякое чистое вещество, независимо от способа получения, всегда имеет постоянный и качественный состав.
Закон Авогадро
В равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул. V=22,4 л/моль
2. Периодический закон, периодическая система Менделеева
Периодический закон Д.И. Менделеева (современная форм-ка).
свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от величины заряда их атомных ядер.
Периодическая система Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра. Периоды 1, 2, 3, 4, 5, 6 содержат соответственно 2, 8, 8, 18, 18, 32 элемента. Седьмой период не завершен. Периоды 1, 2 и 3 называют малыми,остальные - большими.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородным газом (Ne, Ar, Kr, Xe, Rn), которому предшествует типичный неметалл. В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства, поскольку с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне.
Каждый элемент в периодической системе занимает строго определенное положение, которое отмечается порядковым,или атомным,номером.
Сходство элементов внутри каждой подгруппы - наиболее заметная и важная закономерность в периодической системе. В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические. При этом происходит увеличение устойчивости соединений элементов в низшей для данной подгруппы степени окисления. В побочных подгруппах – наоборот – сверху вниз металлические свойства ослабевают и увеличивается устойчивость соединений с высшей степенью окисления.
3. Оксиды, классификация, способы получения, химические свойства?
Оксидаминазываются сложные вещества, в состав молекул которых входят атомы кислорода в степени окисления – 2 и какого-нибудь другого элемента.Они бывают солеобразующими и несолеобразующие. Например, оксид меди (CuO) является оксидом солеобразующим, потому что, например, при взаимодействии её с соляной кислотой (HCl) образуется соль:
CuO + 2HCl → CuCl2 + H2O.
В результате химических реакций можно получать и другие соли:
CuO + SO3 → CuSO4.
Несолеобразующими оксидами называются такие оксиды, которые не образуют солей. Примером могут служить СО, N2O, NO.
Солеобразующие оксиды в свою очередь бывают 3-х типов: основными (от слова«основание»), кислотными и амфотерными.
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na2O + H2O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли
Na2O + SO3 → Na2SO4.
3. Реагируют с кислотами, образуя соль и воду:
CuO + H2SO4 → CuSO4 + H2O.
4. Реагируют с амфотерными оксидами:
Li2O + Al2O3 → 2LiAlO2.
4.Кислоты, классификация, способы получения, химические свойства?
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.(H2SO4). При взаимодействии с основание(и основным оксидом) всегда образуется соль и вода! Так же взаимодействуют с металлом.
Классификация
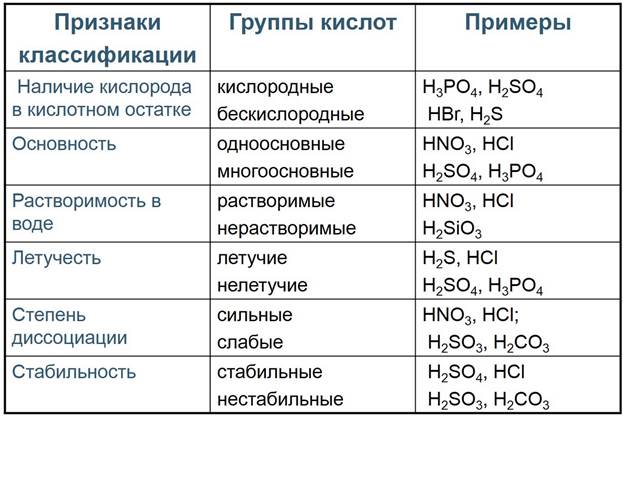 Получение кислот.
Получение кислот.
| Кислородсодержащие | 1.Кислотный оксид+вода | SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4 |
| 2.Неметалл+сильный окислитель | P+5HNO3+2H2O=3H3PO4+5NO | |
| 3.Cоль+менее летучая кислота | NaNO3+H2SO4=HNO3  +NaHSO4 +NaHSO4 | |
| Бескислородные | 1.Водород+неметалл | H2+Cl2=2HCl |
| 2.Cоль+менее летучая кислота | NaCl+H2SO4=2HCl  +NaHSO4 +NaHSO4 |
Химические свойства.
| Кислородсодержащие | Бескислородные |
| 1.Изменяют окраску индикаторов | |
| лакмус-красный, метилоранж-красный ( только для растворимых кислот) | |
| 2.Взаимодействие с металлами, стоящими до водорода | |
H2SO4+Ca=CaSO4+H2  | 2HCl+Ca=CaCl2+H2  |
| 2.Взаимодействие с основными оксидами | |
| H2SO4+CaO=CaSO4+H2O | 2HCl+CaO=CaCl2+H2O |
| 3.Взаимодействие с основаниями | |
| H2SO4+Ca(OH)2=CaSO4+2H2O | 2HCl+Ca(OH)2=CaCl2+2H2O |
| 4.Взаимодействие с амфотерными оксидами | |
| H2SO4+ZnO=ZnSO4+H2O | 2HCl+ZnO=ZnCl2+H2O |
| 5.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество | |
| H2SO4+BaCl2=BaSO4+2HCl | 2HCl+Na2CO3=2NaCl+H2O+CO2  |
| 6.При нагревании | |
| Слабые кислоты легко разлагаются H2SiO3=H2O+SiO2 | H2S=H2+S |
5.Основания, классификация, способы получения, химические свойства?
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция и др.
Получение оснований.
| Щелочи | 1.Металл+вода | 2Na+H2O=2NaOH+H2  Ba+2H2O=Ba(OH)2+H2 Ba+2H2O=Ba(OH)2+H2  |
| 2.Оксид+вода | Li2O+H2O=2LiOH CaO+H2O=Ca(OH)2 | |
| 3.Электролиз растворов щелочных металлов | 2NaCl+2H2O=2NaOH+Cl2+H2  | |
| Нерастворимые основания | Соль+щелочь | CuSO4+2NaOH=Cu(OH)2+Na2SO4 |
Химические свойства оснований.
| Щёлочи | Нерастворимые основания |
| 1.Взаимодействие с кислотами | |
| KOH+HCl=KCl+H2O | Cu(OH)2+2HCl=CuCl2+2H2O |
| 2.Взаимодействие с кислотными оксидами | |
| 2KOH+CO2=K2CO3+H2O | не характерны |
| 3.Действие индикаторов | |
| лакмус-синяя, фенолфталеин-малиновая | окраска не изменяется |
| 4.Взаимодействие с амфотерными оксидами | |
| 2KOH+ZnO=K2ZnO2+H2O | не реагируют |
| 5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание | |
| NaOH+CuCl2=Cu(OH)2=2NaCl | не реагируют |
| 6.При нагревании | |
| не разлагаются(кроме LiOH) | Cu(OH)2=CuO+H2O |
| Амфотерные гидроксиды( Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3 и другие. | |
| Взаимодействуют с кислотами Zn(OH)2+2HCl=ZnCl2+2H2O | Взаимодействуют с щелочами Al(OH)3+NaOH=Na[Al(OH)4] |
6. Соли, классификация, способы получения, химические свойства?
Соляминазываются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция.
Получение солей.
| 1.С использованием металлов | металл+неметалл | Mg+Cl2=MgCl2 |
| металл+кислота | Zn+2HCl=ZnCI2+H2  | |
| металл+соль | Fe+CuSO4=FeSO4+Cu | |
| 2.С использованием оксидов | основной оксид+кислота | CaO+2HCl=CaCl2+H2O |
| кислотный оксид+основание | CO2+Ca(OH)2=CaCO3  +H2O +H2O | |
| кислотный+основной оксиды | CaO+CO2=CaCO3 | |
| основной+амфотерный оксиды | Al2O3+CaO=Ca(AlO2)2 | |
| 3.Реакция нейтрализации | кислота+основание | H2SO4+2NaOH=Na2SO4+2H2O |
| 4.Из солей | соль+соль | AgNO3+NaCl=AgCl  +NaNO3 +NaNO3 |
| соль+щелочь | CuSO4+2NaOH=Cu(OH)2  +Na2SO4 +Na2SO4 | |
| соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2  | |
| Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях(при избытке кислоты) | ||
| NaOH+H2SO4=NaHSO4+H2O | ||
| Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи) | ||
ZnCl2+NaOH=ZnOHCl  +NaCl +NaCl |
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли– все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4.
