Взаимодействие с металлами
5.3.1. При взаимодействии алкилгалогенидов с щелочными металлами происходит реакция Вюрца с образованием алканов:
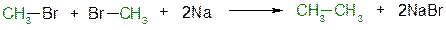
бромметан этан
Реакция протекает через образование натрийорганических соединений и не идёт с третичными алкилгалогенидами.
5.3.2. При взаимодействии с активными двухвалентными металлами образуются очень полезные в синтетическом плане металлоорганические соединения:
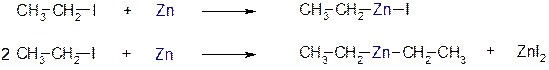
Zn-Органические соединения используются или образуются в реакциях Бутлерова, Зайцева, Вагнера и Реформатского.
Бόльшее значение имеют Mg-органические соединения – реактивы Гриньяра (В. Гриньяр – лауреат Нобелевской премии 1912 г.). Они образуются при выдерживании металлического магния в эфирном растворе, содержащем алкилгалогенид:
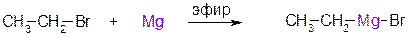
этилбромид этилмагнийбромид
Реактивы Гриньяра в отличие от цинкорганических соединений не воспламеняются на воздухе и являются очень удобными для органического синтеза. Используя реактивы Гриньяра, можно получить самые разнообразные производные: алканы, спирты, карбоновые кислоты, меркаптаны, металлоорганические соединения:
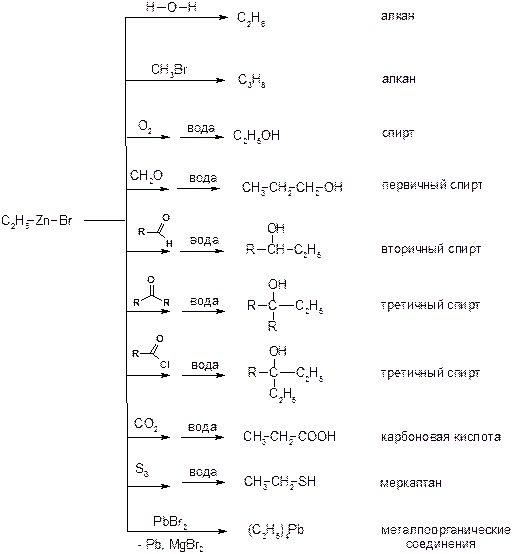
Реакции окисления
Галогенопроизводные горят, образуя углекислый газ, воду и галогеноводороды, например:

При нагревании галогенопроизводного с медью, атомы галогена отщепляются с образованием летучих хлоридов меди, окрашивающих пламя в красивый зелёный или сине-зелёный цвет, – эта качественная реакция на галогенопроизводные называется пробой Бейльштейна.
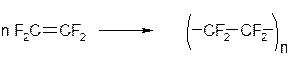
Галогенопроизводные, содержащие большое количество атомов галогена, практически не горят. Например, фторопласт (тефлон) является материалом чрезвычайно устойчивым к действию кислот, щелочей, окислителей и воздуха, поэтому он применяется в производстве изделий электротехнической, радиотехнической и химической промышленности. Фторопласт получают полимеризацией перфторэтилена:
В холодильных установках для отнятия теплоты от охлаждаемого объекта используются особые вещества – хладагенты. В основном для этой цели используются аммиак, элегаз (SF6), некоторые углеводороды (изобутан) и фреоны – фторсодержащие галогенопроизводные метана и этана. Известно около 40 различных фреонов. Примерами фреонов являются: фреон-11 CCl3F, фреон-12 CCl2F2, фреон-13 CClF3,
В отличие от аммиака, фреоны очень инертны в химическом отношении и не ядовиты, а в отличие от изобутана – пожаро- и взрывобезопасны. Кроме того, они устойчивы к действию кислот и щелочей. Поэтому благодаря такой инертности и безопасности фреоны и используются не только как хладагенты в холодильниках, но и как выталкивающая основа в баллончиках и для тушения пожаров.
Однако, у фреонов есть один крупный недостаток: так как они очень инертны, они плохо разрушаются. В верхних слоях атмосферы, поглощая УФ-свет, они гомолитически диссоциируют, образуя атомы хлора (или брома), которые катализируют разрушение озона, защищающего Землю от действия жёсткого УФ-излучения Солнца, губительного для живых организмов и вызывающего мутации и рак кожи.
В 1987 году был разработан так называемый Монреальский протокол – международный договор, предусматривающий для каждой группы фреонов определённый срок, в течение которого их производство должно быть остановлено. К декабрю 2009 года Монреальский протокол был подписан 196 странами. Бывший генеральный секретарь ООН Кофи Аннан однажды заявил, что «возможно, единственным очень успешным международным соглашением можно считать Монреальский протокол» [ru.wikipedia.org/wiki/Монреальский_протокол].
