Тема: Окислительно-восстановительные реакции
Цель: изучить окислительно-востановительные реакции, окислители, восстановители, влияние среды на характер окислительных свойств перманганат-иона, восстановление дихромата калия ионами щавелевой кислоты. Студент должен уметь: определять степень окисления атомов в соединениях, составлять уравнения ОВР, определять эквивалентные массы окислителя и восстановителя.
Оборудование и реактивы: штатив с пробирками, спиртовка. Растворы: сульфат меди(2), серная кислота(2н), гедроксид калия(2н), перманганат калия(0,00/н.), сульфат железа(2), сульфит натрия (сухая соль), гвозди, дихромат калия, щавелевая кислота, наждачная бумага.
Опыт 1 Восстановление ионов меди металлическим железом
В пробирку налейте 5-10 капель раствора сульфата меди и опустите в нее на несколько минут железный гвоздь, поверхность которого очищена наждачной бумагой. Что происходит? Составьте уравнение реакции в молекулярной и ионно-электронной формах.
Опыт 2 Окисление ионов Fe2+ перманганат-ионами
В пробирку налейте 2-3 капли раствора перманганата калия и 2-3 капли 2н. H2SO4. По каплям добавляйте свежеприготовленный раствор сульфата железа до полного обесцвечивания раствора. Составьте уравнение реакций в молекулярной и ионно-электронной форме.
Опыт 3 Окислительные свойства перманганат-иона в различных средах
а) В пробирку налейте 1-2 капли раствора перманганата калия, 1-2 капли концентрированного раствора KOH и по каплям свежеприготовленный раствор сульфита натрия Na2SO3 до перехода малиновой окраски в зеленую. Составьте уравнение реакций в молекулярной и ионно-электронной формах.
б) В пробирку налейте 1-2 капли раствора перманганата калия, 2-3 капли воды и по каплям свежеприготовленный раствор сульфита натрия до образования темно-коричневого осадка. Составьте уравнение реакций в молекулярной и ионно-электронной формах.
в) В пробирку налейте 1-2 капли раствора перманганата калия, 2-3 капли раствора серной кислоты и по каплям до обесцвечивания раствор сульфита натрия. Составьте уравнение реакций в молекулярной и ионно-электронной формах.
Опыт 4 Восстановление дихромата калия K2Cr2O7 ионами щавелевой кислоты.
В пробирку поместите 2-3 капли дихромата калия, прибавьте 2-3 капли 2 н. серной кислоты и 3-5 капель Na2C2O4 до изменения оранжевой окраски в сине-зеленую. Продуктом окисления оксалат-иона C2O42- является CO2. Составьте уравнение реакций в молекулярной и ионно-электронной формах.
Контрольные вопросы
1 Какие реакции называются окислительно-восстановительными?
2 Какое вещество называется окислителем и какое восстановителем? Что с ними происходит в окислительно-восстановительных реакциях?
3 В чем основное отличие реакций ионного обмена от окислительно-восстановительных?
4 Какие из приведенных ниже реакций относятся к окислительно-восстановительным и почему:
а) Fe+CuSO4=FeSO4+Cu б) CuCO3*Cu(OH)2=2CuO+CO2+H2O
в) K2CrO4+BaCl2=BaCrO4+2KCl
5 Какие существуют типы окислительно-восстановительных реакций?
6 Могут ли реакции окисления и восстановления протекать раздельно?
7 Всегда ли выделение элемента в виде простого вещества является следствием его восстановления? Примеры.
8 Могут ли положительно заряженные ионы быть восстановителями? Окислителями? В каких случаях? Примеры.
9 Может ли одно и то же вещество быть окислителем и восстановителем? Примеры.
10 Укажите в периодической системе элементы, обладающие наиболее сильными восстановительными и окислительными свойствами.
11 Составьте электронные схемы и напишите уравнения реакций в молекулярной и ионно-электронной формах:
1) NaNO2+NaI+H2SO4=Na2SO4+NO+I2+H2O
2) KMnO4+KNO2+H2SO4=K2SO4+MnSO4+KNO3+H2O
3) Br2+HNO2+H2O=HBr+HNO3
4) Br2+CrCl3+NaOH=NaBr+Na2CrO4+NaCl+H2O
5) NaNO2+NH4Cl=NaCl+N2+H2O
6) HNO3+As2S3+H2O=NO+H3AsO4+H2SO4
12 У какого из элементов: брома, иода или хлора – окислительные свойства выражены в меньшей степени? Почему?
13 Вычислите ЭДС реакций:
1) HgSO4+FeSO4=Fe2(SO4)3+Hg2SO4
2) PbO2+KI+H2SO4=PbSO4+K2SO4+I2+H2O
3) KMnO4+KCl+H2SO4=K2SO4+MnSO4+H2O+Cl2
4) KMnO4+FeSO4+H2SO4=K2SO4+MnSO4+Fe2(SO4)3+H2O
Рекомендуемая литература
Основная:
1 Хомченко Г.П., Цитович И.К. «Неорганическая химия» М. Высшая школа. 1998г.
2 Князев Д.А., Смарыгин С.Н. «Неорганическая химия» М. Высшая школа. 1990г. глава 12 стр. 152-169
Дополнительная:
3 Ахметов Н.С.Общая неорганическая химия; М.: Высшая школа, 1988
4 Платонов Ф.П. Дейкова З.Е. Практикум по неорганической химии. М.: Высш. шк. , 1985, стр. 124-152.
Приложение А
Таблица Стандартные окислительно-восстановительные потенциалы
| Восстановленная форма | Число теряемых электронов | Окисленная форма | Е, (в) |
| Li K Ba Na Mg Al Zn S2- Fe Ni Pb H2 Cu 2I- MnO2(т)+4OH H2O2 Fe2+ Ag NO2+H2O Hg NH4++3H2O NO+2H2O NO+H2O 2Br- 2Cr3++7H2O 2Cl- Pb2++2H2O Mn2++4H2O MnO2++2H2O 2H2O 2F | Li+ K+ Ba2+ Na+ Mg2+ Al3+ Zn2+ S Fe2+ Ni2+ Pb2+ 2H+ Cu2+ I2 MnO4-+2H2O O2+2H+ Fe3+ Ag+ NO3+2H+ Hg2+ NO3-+10H+ NO3-+4H+ NO2-+2H+ Br2 Cr2O72-+14H Cl2 PbO2+4H+ MnO4-+8H+ MnO4-+4H+ H2O2+2H+ F2 | -3,02 -2,992 -2,90 -2,712 -2,34 -1,67 -0,762 -0,508 -0,44 -0,250 -0,126 -0,0000 +0,345 +0,535 +0,570 +0,682 +0,771 +0,799 +0,81 +0,854 +0,87 +0,95 +0,98 +1,087 +1,330 +1,358 +1,455 +1,52 +1,69 +1,77 +2,85 |
Приложение Б
Таблица Плотность и процентное содержание растворов хлорида натрия
| Концентрация, % (по массе) | Плотность, кг/м3, при температуре | Концентрация, % (по массе) | Плотность, кг/м3, при температуре | ||
| 10` C | 20` C | 10` C | 20` C | ||
Приложение В
Константа диссоциации слабых электролитов (25oC) КДисс
| Слабый электролит | Кдисс | рК = - lgКдисс |
| кислоты | ||
| Азотистая HNO2 | 5,1·10 -4 | 3,29 |
| Муравьиная HCOOH | 1,8 ·10 -4 | 3,74 |
| УксуснаяCH3COOH | 1,8 ·10 -5 | 4,74 |
| Сернистая H2SO3 | К1 = 1,7 ·10-2 | 1,77 |
| К2 = 6,2 ·10-8 | 7,21 | |
| Сероводородная H2S | К1 = 8,9 ·10-8 | 7,05 |
| К2 = 1,3 ·10-13 | 12,89 | |
| Угольная H2CO3 | К1 = 4,5 ·10 –7 | 6,35 |
| К2 = 4,8 ·10 -11 | 10,32 | |
| Кремниевая H2SiO3 | К1 = 2,2 ·10 –10 | 9,66 |
| К2 = 1,6 ·10 -12 | 11,80 | |
| Щавелевая H2C2O4 | К1 = 5,4·10 –2 | 1,27 |
| К2 = 5,4·10 -5 | 4,27 | |
| Селеновая H2SeO3 | К1 = 2,4·10 –3 | 2,62 |
| К2 = 4,8 ·10 -9 | 8,32 | |
| Теллуровая H2TeO3 | К1 = 3·10 –3 | 2,52 |
| К2 = 2 ·10 –8 | 7,70 | |
| Фосфорная H3PO4 | К1 = 7,6·10 –3 | 2,12 |
| К2 = 6,2 ·10 –8 | 7,21 | |
| К3 = 4,4 ·10 -13 | 12,36 | |
| Фтороводородная HF | 6,8 ·10-4 | 3,27 |
| Хлористая HCIO2 | 1,1·10-2 | 1,96 |
| Хлорноватистая HCIO | 5 ·10 -8 | 7,30 |
| Цианистая HCN | 6,2 ·10-10 | 9,21 |
| основания | ||
| Гидроксид аммония NH4OH | 1,8 ·10 -5 | 4,74 |
Приложение Г
Константы нестойкости комплексных ионов(25оС )
| Уравнение диссоциации комплексного иона | Константа нестойкости | Константа устойчивости |
[Ag (NH3)2]+ 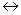 Ag + + 2NH3 Ag + + 2NH3 | 9,3·10-8 | 1,07·107 |
[Ag (NO2)2]- 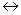 Ag + + 2NO2- Ag + + 2NO2- | 1,8 ·10-3 | 5,5·102 |
[Ag (CN)2]- 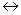 Ag + + 2CN- Ag + + 2CN- | 1,1·10-21 | 9,1·1020 |
[Au (CN)2]- 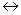 Au++2CN- Au++2CN- | 5·10-39 | 2,0·1038 |
[HgCI4]2- 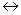 Hg2+ + 4CI- Hg2+ + 4CI- | 8,5 · 10-16 | 1,1·1015 |
[HgBr4]2- 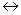 Hg2+ + 4Br- Hg2+ + 4Br- | 1,0 · 10-21 | 1,0·1021 |
[HgI4]2- 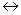 Hg2+ + 4I- Hg2+ + 4I- | 1,5 · 10-30 | 6,7·1029 |
[Hg(CN)4]2- 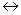 Hg2+ + 4CN- Hg2+ + 4CN- | 4,0 ·10-42 | 2,5·1041 |
[Cd (NH3)4]2+ 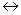 Cd2+ + 4NH3 Cd2+ + 4NH3 | 7,6· 10-8 | 1,3·107 |
[Cd (CN)4]2- 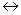 Cd2+ + 4CN- Cd2+ + 4CN- | 7,8 ·10-18 | 1,28·1017 |
[Co (NH3)6]2+ 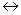 Co2+ + 6NH3 Co2+ + 6NH3 | 7,3·10-6 | 1,37·107 |
[Co (NH3)6]3+ 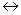 Co3+ + 6NH3 Co3+ + 6NH3 | 3,1·10-33 | 3,3·1032 |
[Co (CN)6]4- 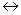 Co2+ + 6CN- Co2+ + 6CN- | 8,1·10-18 | 1,25·1017 |
[Cu (NH3)4]2+ 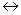 Cu2+ +4NH3 Cu2+ +4NH3 | 2,1 ·10 –13 | 4,8·1012 |
[Cu (CN)4]2- 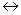 Cu+ +4CN- Cu+ +4CN- | 5 ·10 –31 | 2,0·1030 |
[Ni (NH3)6]2+ 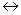 Ni2+ + 6NH3 Ni2+ + 6NH3 | 1,9 · 10-9 | 5,2·108 |
[PbCI4]2- 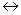 Pb2+ + 4CI- Pb2+ + 4CI- | 4,5 · 10-2 | 2,2·101 |
[PbI4]2- 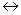 Pb2+ + 4I- Pb2+ + 4I- | 8 · 10 –3 | 1,25·102 |
[Fe(CN)6]3- 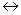 Fe3+ + 6CN- Fe3+ + 6CN- | 1,2 ·10 –44 | 9,1·1043 |
[Fe(CN)6]4- 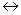 Fe3+ + 6CN- Fe3+ + 6CN- | 1,5 ·10 -37 | 6,7·1036 |
Приложение Д
Плотность растворов кислот и оснований( г/см3)
| Массалық үлесi, % | H2SO4 | HNO3 | HCI | KOH | NaOH | NH3 | |
| 1,013 1,027 1,040 1,055 1,069 1,083 1,098 1,112 1,127 1,143 1,158 1,174 1,190 1,205 1,224 1,238 1,255 1,273 1,290 1,307 1,324 1,342 1,361 1,380 1,399 1,419 1,439 1,460 1,482 1,503 1,525 1,547 1,571 1,594 1,611 | 1,011 1,022 1,033 1,044 1,054 1,068 1,080 1,093 1,106 1,119 1,132 1,140 1,158 1,171 1,84 1,198 1,211 1,225 1,238 1,251 1,264 1,277 1,290 1,303 1,316 1,328 1,340 1,351 1,362 1,373 1,384 1,394 1,403 1,412 1,421 | 1,009 1,019 1,029 1,039 1,049 1,059 1,069 1,079 1,089 1,100 1,110 1,121 1,132 1,142 1,152 1,163 1,173 1,183 1,194 - - - - - - - - - - - - - - - - | 1,016 1,033 1,048 1,065 1,082 1,100 1,118 1,137 1,156 1,176 1,196 1,217 1,240 1,263 1,286 1,310 1,334 1,358 1,384 1,411 1,437 1,460 1,485 1,511 1,538 1,564 1,590 1,616 - - - - - - - | 1,023 1,046 1,069 1,092 1,115 1,137 1,159 1,181 1,203 1,225 1,247 1,268 1,289 1,310 1,332 1,352 1,374 1,395 1,437 1,458 1,478 1,499 1,519 1,540 1,560 1,580 1,601 1,622 1,643 - - - - - | 0,992 0,983 0,973 0,967 0,960 0,953 0,946 0,939 0,932 0,926 0,919 0,913 0,908 0,903 0,898 0,893 0,889 0,884 - - - - - - - - - - - - - - - - - | ||
| 1,640 1,664 1,687 1,710 1,732 1,755 1,776 1,793 1,808 1,819 1,830 1,837 1,840 1,841 1,8305 | 1,429 1,437 ,445 1,453 1,460 1,467 1,474 1,480 1,486 1,491 1,496 1,500 1,504 1,510 1,522 | - - - - - - - - - - - - - - - | - - - - - - - - - - - - - - - | - - - - - - - - - - - - - - - | - - - - - - - - - - - - - - - | ||
