Тема 8: Окислительно-восстановительные реакции
Окислительно-восстановительные реакции – это реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ:
H20 + Cl20 = 2H+Cl-
Процесс отдачи электронов атомов молекулой или ионом называется окислением, а сам элемент – восстановителем.
Процесс присоединения элементов атома молекулой и ионом называется восстановлением, а элемент – окислителем.
Пример 1.Уравняйте реакции методом электронного баланса, укажите окислитель и восстановитель
а) KI+FeCl3®I2+FeCl2+KCl
б) (NH4)2Cr2O7®Cr2O3+N2+H2O
в) K2SO3®K2SO4+K2S
Решение:
а) KI+FeCl3®I2+FeCl2+KCl
Окислительно-восстановительная реакция состоит из двух процессов: окисления ионов йода и восстановления ионов железа (III). Выразим перемещение электронов от ионов йода к трехзарядным ионам железа электронными уравнениями:
 1
1 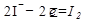 окисление (восстановитель)
окисление (восстановитель)
2 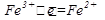 восстановление (окислитель)
восстановление (окислитель)
Число принятых электронов должно равняться числу отданных электронов, поэтому слева ставим коэффициенты 1 и 2. Это означает, что два иона окисляются двумя ионами железа.
Теперь составим полное уравнение реакции:
2KI+2FeCl3®I2+2FeCl2+2KCl
б) (NH4)2Cr2O7®Cr2O3+N2+H2O
 1
1 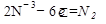 окисление (восстановитель)
окисление (восстановитель)
1 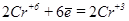 восстановление (окислитель)
восстановление (окислитель)
в) K2SO3®K2SO4+K2S
 3
3 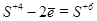 окисление (восстановитель)
окисление (восстановитель)
1 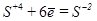 восстановление (окислитель)
восстановление (окислитель)
Пример 2. Уравняйте реакцию ионно-электронным методом:
KMnO4+H2S+H2SO4 ® MnSO4+S+K2SO4+H2O
Решение: В процессе протекания реакции ион 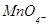 превращается в Мп2+, при этом перманганат-ион теряет четыре атома кислорода. В кислой среде кислород отнимают с помощью ионов Н+ и в результате образуется вода.
превращается в Мп2+, при этом перманганат-ион теряет четыре атома кислорода. В кислой среде кислород отнимают с помощью ионов Н+ и в результате образуется вода.
MnO4- +8H+ ® Mn2++4H2O
Суммарный заряд ионов правой части схемы составляет +7, а левой +2. Для уравнения зарядов в левой части добавляем пять электронов и получаем полуреакцию в окончательном виде:
MnO4- +8H++5 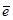 = Mn2++4H2O
= Mn2++4H2O
Вторая полуреакция имеет вид: H2S-2 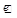 = S+2H+
= S+2H+
Для составления суммарного уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв число отданных и принятых электронов:
 2
2 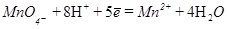 окисление (восстановитель)
окисление (восстановитель)
5 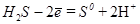 восстановление (окислитель)
восстановление (окислитель)
2MnO4- +16H++5H2S = 2Mn2++5S0+10H++ 8H2O
Исключив 10Н+ из левой и правой частей уравнения, получим ионно-молекулярное уравнение:
2MnO4- +6H++5H2S = 2Mn2++5S0+8H2O
2K+ 3SO42- 2SO42- 2K+ + SO42-
Чтобы перейти к молекулярному уравнению, следует к каждому аниону приписать соответствующий катион, а к каждому катиону – анион:
2KMnO4+5H2S+3H2SO4 = 2MnSO4+5S+K2SO4+8H2O
Контрольные задания:
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем.
141.KNO3®KNO2+O2
KMnO4+FeSO4+H2SO4®MnSO4+Fe2(SO4)3+K2SO4+H2O
NO2+H2O®HNO3+HNO2
142.KMnO4+KNO3+H2SO4®MnSO4+KNO3+K2SO4+H2O
I2+Ba(OH)2®Ba(IO3)2+BaI2+H2O
K2Cr2O7+KI+H2SO4®Cr2(SO4)3+I2+K2SO4+H2O
143.(NH4)2Cr2O7®Cr2O3+N2+H2O
KClO3+KI+H2SO4®KCl+I2+K2SO4+H2O
Zn+H2SO4®H2S+ZnSO4+H2O
144. K2SO4+C®K2S+CO2
K2Cr2O7+H3PO3+H2SO4®H3PO4+K2SO4+Cr2(SO4)3+H2O
КMnO4+KNO2+H2O=MnO2+KNO3+KOH
145. Pb(NO3)2®PbO+NO2 +O2
KСrO2+KNO2+H2SO4®CrSO4+KNO3+K2SO4+H2O
Na+HNO3®NaNO3+NH4NO3+H2O
146. AgNO3®Ag+NO2+O2
P+KOH+H2O®PH3+KH2PO2
K2Cr2O7+Na2S+H2SO4®S+Cr2(SO4)3+K2SO4+Na2SO4+H2O
147. NH4NO2®N2+H2O
KMnO4+H2S+H2SO4®MnSO4+S+K2SO4+H2O
S+KOH®K2SO4+K2S+H2O
148.MgSO4®MgO+SO2+O2
KMnO4+SnSO4+H2SO4®MnSO4+Sn(SO4)2+K2SO4+H2O
KСlO3+FeSO4+H2SO4®KCl+Fe2(SO4)3+H2O
149. KBrO®KBrO3+KBr
Al+H2O+KOH®K[Al(OH)4]+H2
CO+KMnO4+H2SO4®MnSO4+K2SO4+CO2+H2O
150. CaSO4®CaO+SO2+O2
P+HNO3®H3PO4+NO2+H2O
K2MnO4+H2SO4®KMnO4+MnO2+K2SO4+H2O
151.NH4NO3®N2O+H2O
KCrO2+PbO+H2SO4®CrSO4+Pb(SO4)2+K2SO4+H2O
HNO2®HNO3+NO+H2O
152. Fe+O2+H2O®Fe(OH)3
P+H2O®H3PO4+PH3
Cu+HNO3®Cu(NO3)2+NO+H2O
153. KСlO4®KCl+O2
H2O2®H2O+O2
Al+K2Cr2O7+H2SO4®Al2(SO4)3+Cr2(SO4)3+K2SO4+H2O
154. Ag2O®Ag+O2
K2Cr2O7+KNO2+H2SO4®KNO3+Cr2(SO4)3+K2SO4+H2O
K2MnO4+H2O®KMnO4+MnO2+KOH
155.NOCl®NO+Cl2
KClO3+FeSO4+H2SO4®KCl+Fe2(SO4)3+H2O
K2Cr2O7+HCl®Cl2+CrCl3+KCl+H2O
156. Cu(NO3)2®CuO+NO2+O2
KMnO4+H2O2+HCl®O2+MnCl2+KCl+H2O
Cl2+H2O®HclO3+HCl
157. CuI2®CuI+I2
FeSO4+H2O2+H2SO4=Fe2(SO4)3+H2O
I2+H2O®HIO3+HI
158.HNO3®NO2+O2+H2O
Na2CrO4+NaI+H2SO4®Cr2(SO4)3+I2+Na2SO4+H2O
I2+HNO3®HIO3+NO2+H2O
159. Na2CO3+SO2+O2®Na2SO4+CO2
K2CrO4+HCl®Cl2+CrCl3+KCl+H2O
NaBiO3+MnO2+H2SO4=Bi2(SO4)3+NaMnO4+Na2SO4+H2O
160. Pb3O4+HCl®PbCl2+Cl2+H2O
KMnO4+KNO2+H2O®MnO2+KNO3+KOH
K2Cr2O7+HCl®CrCl3+Cl2+KCl+H2O
