Номенклатура и классификация ферментов
В настоящее время известно более двух тысяч химических реакций, катализируемых ферментами, и число это непрерывно возрастает. Чтобы ориентироваться в таком множестве превращений, ещё в 1961 году Международной комиссией по ферментам (IEC) были разработаны принципы рациональной международной классификации и номенклатуры, при помощи которой любой фермент можно было бы точно идентифицировать.
В основу классификации положен важнейший признак, по которому один фермент отличается от другого – это катализируемая им реакция. Приведенная ниже классификация ферментов основана на рекомендациях Комитета по номенклатуре Международного Объединения Биохимии и Молекулярной Биологии (NC-IUBMB). Число типов химических реакций сравнительно невелико, что позволило разделить все известные в настоящее время ферменты на 6 важнейших классов, в зависимости от типа катализируемой реакции. Такими классами являются:
1. Оксидоредуктазы (окислительно-восстановительные реакции);
2. Трансферазы (перенос функциональных групп);
3. Гидролазы (реакции расщепления с участием воды);
4. Лиазы (разрыв связей без участия воды);
5. Изомеразы (изомерные превращения);
6. Лигазы (синтез с затратой молекул АТФ).
Ферменты каждого класса делят на подклассы, руководствуясь строением субстратов. В подклассы объединяют ферменты, действующие на сходно построенные субстраты. Подклассы разбивают на подподклассы, в которых ещё строже уточняют структуру химических групп, отличающих субстраты друг от друга. Внутри подподклассов перечисляют индивидуальные ферменты. Все подразделения классификации имеют свои номера. Таким образом, любой фермент получает свой уникальный кодовый номер (шифр), со стоящими перед ним буквами КФ («Каталог ферментов», английская аббревиатура ЕС). Шифр каждого фермента содержит четыре числа, разделенных точками. Первое число обозначает класс, второе – подкласс, третье – подподкласс, четвёртое – номер фермента в пределах подподкласса.
Согласно классификации, каждый фермент имеет два названия: рекомендуемое (рабочее), предназначенное для повседневного употребления, и систематическое, которое составляется в определенном порядке и подчеркивает тип катализируемой реакции. Систематическое название составляется из двух частей. Первая часть содержит название субстрата или субстратов, часто – наименование кофермента, вторая часть указывает на природу катализируемой реакции и включает название класса, к которому относится данный фермент. При необходимости приводится дополнительная информация о реакции в скобках после второй части названия. Систематическое название присваивается только тем ферментам, каталитическое действие которых полностью изучено.
Пример. Систематическое название фермента АТР: D-гексозо-6-фосфотрансфераза (КФ 2.7.1.1) указывает на то, что этот энзим катализирует перенос фосфатной группы от АТР на гидроксильную группу атома углерода в шестом положении гексозы; фермент относится к классу 2 (трансферазы); подклассу 7 (перенос фосфатных групп); подподклассу 1 (акцептором фосфата являются спирты). Рекомендуемое (рабочее) название этого фермента – гексокиназа.
В ряде случаев сохранились тривиальные названия, присвоенные ферментам на ранних этапах их изучения, когда название фермента включало только субстрат, на который действует данный фермент и окончание «-аза». Так, ферменты, обеспечивающие гидролиз крахмала (амилон), были названы амилазами; ферменты, гидролизующие жиры (липос) – липазами; ферменты, гидролизующие белки (протеины) – протеазами. Также в употреблении сохранился ряд рабочих, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например: пепсин, трипсин, химотрипсин, тромбин и т.д.
Класс 1: Оксидоредуктазы. Катализируют окислительно-восстановительные реакции, в которых, как правило, участвуют два субстрата, S и S¢:
Общая схема реакций, катализируемых оксидоредуктазами, включающих субстраты S и S¢, может быть выражена следующим образом:
Sвосст + S¢окисл → Sокисл + S¢восст
В окислительно-восстановительных реакциях происходит перенос двух восстановительных эквивалентов в той или иной форме (атомов водорода, электронов, гидрид-ионов и т.д.) от одного субстрата (окисляемого) к другому (восстанавливаемому). Субстрат, подвергающийся окислению, рассматривается как донор водорода (S), а субстрат, который восстанавливается – акцептором водорода (S¢). Систематическое название составляется по схеме: – донор: акцептор оксидоредуктаза. Согласно тривиальной номенклатуре, общее название оксидоредуктаз, отщепляющих атомы водорода или электроны и переносящих их на любой акцептор, кроме кислорода, представлено дегидрогеназами. Как альтернатива, некоторые ферменты, которые преимущественно характеризуются восстанавливающим действием, носят название редуктаз. Оксидоредуктазы, использующие кислород в качестве акцептора атомов водорода или электронов, называются оксидазами. Ферменты, осуществляющие перенос электронов, называются цитохромами.
Подклассы оксидоредуктаз формируются в зависимости от природы функциональной группы донора водорода (электронов). Деление на подподклассы зависит от акцептора электронов:
Подкласс 1.1составляют оксидоредуктазы, действующие на спиртовые группы доноров, окисляя их до альдегидных или кето-групп.
Дегидрогеназы,катализируют реакции дегидрирования (отщепления от одного субстрата атомов водорода и переноса на другие субстраты):
SH2 → S + 2Н
В качестве акцептора водорода используются NAD+, NADP+.
Пример:
алкогольдегидрогеназа (алкоголь: NAD-оксидоредуктаза, КФ 1.1.1.1) участвует в метаболизме этанола в тканях.

Кроме окисления спиртов, ферменты этого подкласса участвуют в дегидрировании оксикислот (лактата, малата, изоцитрата), моносахаридов, сахароспиртов и оксистероидов.
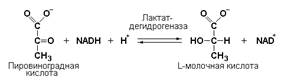
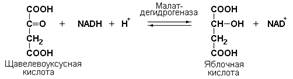
Как было указано выше, редуктазы катализируют реакции гидрирования (присоединяют атомы водорода к субстрату):
S + 2H → SH2
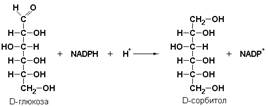
Пример:
альдозоредуктаза (КФ 1.1.1.21) восстанавливает глюкозу до сорбитола:
Наконец, оксидоредуктазы использующие молекулярный кислород в качествеакцептора – оксидазы катализируют перенос атомов водорода или электронов непосредственно на молекулу О2:
SН2 + ½О2 → S + Н2О
В качестве коферментов в таких реакциях выступают производные витамина В2 – FAD и FMN.
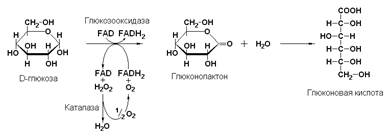
Пример:
глюкозооксидаза, являющаяся FAD-зависимым ферментом (β-D-глюкоза: кислород-оксидоредуктаза, КФ 1.1.3.4) катализирует окисление β-D-глюкозы молекулярным кислородом без включения его атомов в молекулу субстрата:
D-глюкоза + FAD + О2 → FADН2 + глюконолактон + Н2О2
глюконолактон + Н2О → глюконовая кислота
Подкласс 1.2 оксидиредуктаз включает ферменты, действующие на карбонильные (альдегидные или кето-группы) группы доноров. Эти ферменты окисляют альдегиды и кетоны до карбоновых кислот.
Пример:
глицеральдегид-3-фосфатдегидрогеназа (D-глицеральдегид-3-фосфат: NAD-оксидоредуктаза (фосфорилирующая), КФ 1.2.1.12) катализирует одну из промежуточных реакций гликолитического распада глюкозы:
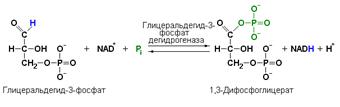
Важно отметить, что продукт этой реакции содержит богатую энергией фосфатную связь в 1-ом положении. Остаток фосфорной кислоты, образующий эту связь, может быть легко перенесён от 1,3-дифосфоглицерата на ADP с образованием ATP.
Ферментыподкласса 1.3действуют на –СН2–СН2– связи субстратов-доноров. В результате катализируемых этими ферментами реакций, насыщенные связи –СН2–СН2– превращаются в связи ненасыщенные –СН=СН–, то есть происходит превращение насыщенных соединений в соединения с двойными связями.
Пример:
фермент цикла трикарбоновых кислот сукцинатдегидрогеназа (сукцинат: акцептор-оксидоредуктаза, КФ 1.3.99.1) ускоряет окисление янтарной кислоты в ненасыщенную фумаровую кислоту:

Подкласс 1.4включает оксидоредуктазы, действующие на –CH–NH2-группировки доноров. Эти ферменты катализируют окислительное дезаминирование аминокислот и биогенных аминов с высвобождением аммиака (NH4+). Амины при этом превращаются в альдегиды или кетоны, аминокислоты – в кетокислоты.
Пример:
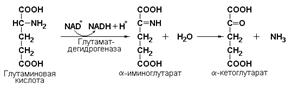
глутаматдегидрогеназа (L-глутамат: NAD(P)-оксидоредуктаза (дезаминирующая), КФ 1.4.1.3) принимает участие в окислительном дезаминировании глутаминовой кислоты:
Подкласс 1.8объединяет оксидоредуктазы действующие на серосодержащие группы субстратов-доноров. Данные ферменты катализируют окисление тиоловых (сульфгидрильных) групп до дисульфидных, а сульфитов – до сульфатов.
Пример:
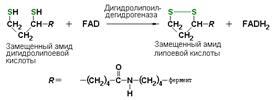
дигидролипоилдегидрогеназа (КФ 1.8.1.4), катализирующая одну из промежуточных реакций окислительного декарбоксилирования пирувата:
Подкласс 1.9 объединяет электрон-транспортные белки – цитохромы, являющиеся переносчиками электронов в процессах внутриклеточного дыхания, окислительного фосфорилирования, фотосинтеза, ферментативного гидроксилирования и других важных биологических окислительно-восстановительных реакциях. Эти ферменты относятся к гемопротеидам, содержащим в качестве простетической группы гемовую группировку. Как правило, цитохромы образуют так называемые цепи, по которым электроны последовательно переносятся от донора к конечному акцептору. При этом обратимо изменяется степень окисления простетической группы [Fe(II) ↔ Fe(III)].
Подкласс 1.11 включает ферменты, катализирующие реакции разложения пероксида водорода с участием восстанавливающих агентов (аскорбатов, хинонов, цитохрома С, глутатиона). Общее уравнение реакции:
Н2О2 + SН2 → 2Н2О + Sокисл
Пример:
глутатионпероксидаза (глутатион: Н2О2-оксидоредуктаза. КФ 1.11.1.9) катализирует реакцию разложения перекиси водорода с участием восстановительного агента – сульфгидрильной формы глутатиона. Фермент участвует в инактивации пероксида водорода в эритроцитах, клетках печени, играет важную защитную роль в мозговой ткани, содержащей невысокие количества каталазы:

каталаза (перекись водорода: Н2О2-оксидоредуктаза. КФ 1.11.1.6) катализирует реакцию разложения перекиси водорода без участия восстановительного агента:
2Н2О2 → 2Н2О + О2
Ферментыподкласса 1.13включающие в окисляемый субстрат (донор электронов) молекулярный кислород имеют общее название оксигеназ. Ферменты данного подкласса присутствуют во всех типах клеток. Они участвуют в гидроксилировании многих эндогенных соединений в частности аминокислот, фенолов, стеринов и др.
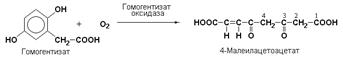
Наиболее важными представителями подкласса 1.13 являются оксигеназы, составляющие подподкласс 1.13.11– диоксигеназы. Данные ферменты катализируют превращения, в ходе которых оба атома молекулы О2 включаются в состав окисляемого субстрата. Например, в процессе катаболизма фенилаланина и тирозина происходит образование гомогентизата, который с участием гомогентизат-1,2-диоксигеназы (КФ 1.13.11.5) окисляется до 4-малеилацетоацетата.
Подкласс 1.14объединяет, главным образом, ферменты монооксигеназы (гидроксилазы),обладающие способностью внедрять один атом молекулярного кислорода в окисляемый субстрат.
К подподклассу 1.14.14 относятся множественные формы цитохрома Р450 (КФ 1.14.14.1) микросом печени и митохондрий коры надпочечников, которые катализируют реакции гидроксилирования, N-, S-, и О-деалкилирования, N-, S-окисления ксенобиотиков, а также принимают участие в ключевых реакциях стероидогенеза.
Микросомалъная гидроксилирующая система печени метаболизирует множество лекарств, канцерогенов, анэстетиков и других ксенобиотиков. Эти реакции нацелены на превращение липофильных, неполярных соединений в гидрофильные, полярные, которые затем легко выводятся из организма. В реакциях обезвреживания множества инородных соединений, протекающих в эндоплазматическом ретикулуме клеток печени с участием цитохрома Р-450, в качестве восстановителя используется NADPH.
К подподклассу 1.14.16 относят ферменты, катализирующие окисление органических соединений молекулярным кислородом. В результате реакции происходит включение одного из атомов кислорода в молекулы этих субстратов. При этом второй атом кислорода включается в молекулу воды. Так, реакция превращения фенилаланина в тирозин катализируется фенилаланин-4-монооксигеназой (КФ 1.14.16.1):
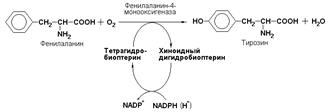
Данный фермент, называемый также оксидазой со смешанной функцией, в качестве восстановителя в реакции гидроксилирования фенилаланина использует переносчик электронов, называемый тетрагидробиоптерином. Это соединение, выступающее в качестве кофактора фенилаланингидроксилазы в целом представляет собой соединение, родственное фолиевой кислоте и служит кофактором нескольких других гидроксилаз.
2 класс: Трансферазы. Ферменты этого класса катализируют перенос различных групп от молекулы донора к молекуле акцептору:
S-R + S′ → S′-R +S
Подразделение трансфераз на подклассы зависит от природы переносимых группировок:
К подклассу 2.1относятся ферменты, ускоряющие перенос одноуглеродных фрагментов – метильных (–CH3), метиленовых (–СН2–), метенильных (–СН=), формильных (–СОН) и других родственных им групп.
Пример:
гуанидинацетат-метилтрансфераза (S-аденозилметионин-гуанидинацетат-метилтрансфераза, КФ 2.1.1.2) катализирует образование биологически активного важного соединения креатина:
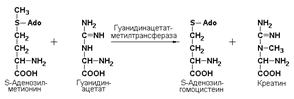
Ферменты подкласса 2.2переносят альдегидные и кетонные группы.К этому подклассу ферментов относятся: транскетолаза (КФ 2.2.1.1) и трансальдолаза (КФ 2.2.1.2). Данные ферменты в неокислительной фазе пентозофосфатного пути катализируют перенос двух- и трёхуглеродных фрагментов, соответственно, используя в качестве донора углеродных фрагментов кетозу, в качестве акцептора – альдозу. Указанные реакции протекают в два этапа: сначала происходит отщепление углеродного фрагмента от молекулы-донора, а затем – перенос этого фрагмента на молекулу, выполняющую роль акцептора.
Подкласс 2.3 включает ферменты, называемые ацилтрансферазами, которые переносят остатки карбоновых кислот. Ферменты данного подкласса катализируют реакции трансацетилирования – перенос остатков различных кислот (уксусной, пальмитиновой и др.) преимущественно от тиоэфиров коэнзима А на различные акцепторы.
Пример:
холинацетилтрансфераза (ацетил-КоА: холин-О-ацетилтрансфераза, КФ 2.3.1.6) катализирует образование нейромедиатора ацетилхолина:
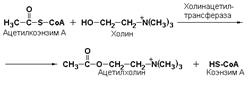
Ферменты подкласса 2.4 – гликозилтрансферазы катализируют перенос гликозильных остатков от фосфорных эфиров сахаров на молекулы моносахаридов, полисахаридов и других соединений. Если гликозильный остаток переносится на молекулу фосфорной кислоты, процесс называется фосфоролизом, а ферменты, катализирующие такую реакцию, называют фосфорилазами. Эти ферменты, в частности, играют ведущую роль в синтезе гликогена и крахмала, а принимают участие на начальных этапах мобилизации этих полисахаридов.
Пример:
мальтозофосфорилаза катализирует реакцию фосфоролиза (расщепления) мальтозы:
мальтоза + Н3РО4 → глюкозо-1-фосфат + глюкоза
Подкласс 2.6включает ферменты, участвующие в переносе азотсодержащих групп. Реакции трансаминирования аминокислот, катализируемые ферментами этого подкласса протекают с участием трансаминаз, называемых также аминотрансферазами. Эти реакции являются общими реакциями, как для катаболических, так и анаболических путей промежуточного обмена аминокислот. Принцип реакций трансаминирования состоит в переносе аминогруппы от α-аминокислоты (без промежуточного образования свободного аммиака) на α-кетокислоту с образованием новой α-кето- и новой α-аминокислоты. Одним из наиболее важных ферментов переаминирования является аланинаминотрансфераза (L-аланин: 2-оксоглутарат-аминотрансфераза, КФ 2.6.1.2), катализирующая реакцию:
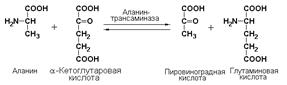
Ферменты подкласса 2.7 – фосфотрансферазы переносят фосфатные группы. Эта группа ферментов катализирует биохимические процессы, связанные с переносом остатков фосфорной кислоты на различные субстраты. При этом происходит превращение ряда веществ в органические фосфоэфиры, обладающие высокой химической активностью и легко вступающие в последующие реакции. Фосфотрансферазы, использующие в качестве донора фосфата АТР, принято называть киназами.
Пример:
гексокиназа (ATР: D-гексозо-6-фосфотрансфераза, КФ 2.7.1.1.) катализирует перенос фосфатной группы с АТР на моносахариды:
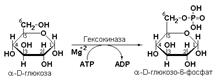
фосфоглицераткиназа (АТР: D-3-фосфоглицерат-1-фосфотрансфераза, КФ 2.7.2.3) осуществляет превращение 1,3-дифосфоглицерата в 3-фосфоглицерат:
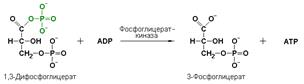
В этой реакции происходит обратный перенос фосфатной группы с субстрата на АDP с образованием АТP. Подобные реакции фосфорилирования АDP с образованием АТP, сопряжённые с превращением субстрата (а не с переносом электронов в дыхательной цепи), получили название реакций субстратного фосфорилирования. Роль этих реакций в клетке значительно возрастает при недостатке кислорода в тканях.
протеинкиназы катализируют реакции переноса остатка фосфорной кислоты на белки, после чего резко изменяется их биологическая активность, что влияет на регуляцию метаболизма.
3 класс: Гидролазы. Ферменты этого класса катализируют реакции расщепления связей в различных соединениях с участием воды:
А-В + H2O → А-H + В-OH
Гидролазы делятся на подклассы в зависимости от природы гидролизуемой связи. Наиболее важные гидролазы принадлежат следующим подклассам:
Подкласс 3.1 представлен эстеразами, которые катализируют реакции гидролиза сложноэфирных связей.
Деление на подподклассы зависит от природы сложноэфирной связи и класса субстрата:
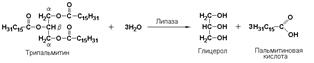
К подподклассу 3.1.1 относятся эстеразы гидролизующие сложные эфиры, образованные спиртами и карбоновыми кислотами. К ним относятся липазы, катализирующие реакции гидролиза жиров.
Пример:
триацилглицероллипаза (гидролаза эфиров глицерола, КФ 3.1.1.3), катализирует реакцию гидролиза сложноэфирных связей в молекуле триацилглицерола:
Фосфатазы относящиеся к подподклассу 3.1.3 катализируют гидролиз моноэфиров фосфорной кислоты.
Пример:
глюкозо-6-фосфатаза катализирует реакцию отщепления остатка фосфорной кислоты от глюкозо-6-фосфата:
глюкозо-6-фосфат ↔ глюкоза + Н3РО4
Фосфодиэстеразы (подподкласс 3.1.4) катализируют реакции гидролиза диэфиров фосфорной кислоты.
Пример:
3',5'-циклонуклеотид-фосфодиэстераза осуществляет гидролиз сАМР и сGMP.
Ферменты подкласса 3.2 – гликозидазы катализируют реакции гидролиза гликозидных связей. К данному подклассу гидролаз относятся ферменты, гидролизующие О-гликозидные связи в молекулах поли- и олигосахаридов, а также других соединений, содержащих моносахаридные остатки (например, гликозидов).
Характерным представителем является сахараза (β-D-фруктофуранозид-фруктогидролаза, КФ 3.2.1.26), катализирующая расщепление сахарозы:
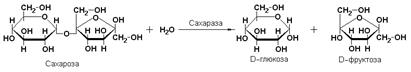
Подкласс 3.4.гидролаз объединяет ферменты пептидазы, действующие на пептидные связи в белках, полипептидах и олигопептидах. По месту атаки пептидной связи в молекуле субстрата пептидазы делятся на эндопептидазы и экзопептидазы.
Экзопептидазы гидролизуют пептидные связи образованные аминокислотами на N- или С-концах полипептидной цепи:
аминопептидазы(N-концевые экзопептидазы)осуществляют гидролитическое отщепление аминокислот с NH2-конца полипептидной цепи;
карбоксипептидазы (С-концевые экзопептидазы) осуществляет гидролитическое отщепление аминокислот с СООН-конца полипептидной цепи;
дипептидазы катализируют гидролиз дипептидов.
Эндопептидазы (протеиназы)расщепляют пептидные связи между определёнными аминокислотными остатками внутри пептидной цепи:
Сериновые протеиназы – эндопептидазы, содержащие в активном центре остаток серина, обладающего повышенной реакционной способностью.
Пример:
химотрипсин действует избирательно на пептидные связи, образованные карбоксильными группами ароматических кислот и аминокислот с гидрофобными радикалами большого размера, например метионина;
трипсин катализирует преимущественное гидролитическое расщепление пептидов по карбоксильным группам аргинина и лизина.
Аспартатные протеиназы – эндопептидазы, содержащие в активном центре остаток аспарагиновой кислоты.
Пример:
пепсин преимущественно расщепляет пептидные связи, образованные аминогруппами ароматических аминокислот – тирозина, фенилаланина и триптофана, а также связи Ala-Ala и Ala-Ser.
Ферменты подкласса 3.5 – амидазы гидролизуют амиды органических кислот.
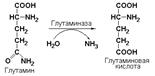
Глутамин, являющийся амидом глутаминовой кислоты, представляет собой одну из 20 протеиногенных аминокислот, необходимых для синтеза белка. Кроме того, в почках глутамин является основным источником экскретируемого аммиака. Таким образом, аммиак переносится в кровь в виде нетоксичного, неионизованного амида, который играет важную роль в регуляции рН мочи за счет нейтрализации кислых продуктов обмена аммиаком, высвобождаемым при простом гидролизе амидной группы под действием почечной глутаминазы (L-глутамил-амидогидролаза, КФ 3.5.1.2).
4 класс: Лиазы. Ферменты данного класса катализируют негидролитическое расщепление субстрата с образованием кратной связи или цикла, а также обратные реакции – присоединение по кратным связям или реакции раскрытия цикла, не требующие гидролиза АТР:
А—В → А + В
Эти ферменты используют в качестве кофакторов тиаминпирофосфат (витамин В1) и пиридоксальфосфат (витамин В6).
Лиазы подразделяют на подклассы в зависимости от типа расщепляемой связи:
Лиазы подкласса 4.1 относящиеся к углерод-углерод лиазам катализируют расщепление связи С—С.
Подподкласс 4.1.1 включает карбокси-лиазы (декарбоксилазы) катализирущие реакции декарбоксилирования α-кетокислот и аминокислот с отщепление СО2.
Пример:
пируватдекарбоксилаза в процессе анаэробного гликолиза декарбоксилирует пировиноградную кислоту с образованием ацетальдегида и СО2:
CH3COCOOH → CH3CHO + CO2
Реакция протекает с участием тиаминпирофосфата в качестве кофермента.
Альдегид-лиазы (альдолазы), относящиеся к подподклассу 4.1.2катализируют альдольную конденсацию и обратную ей реакцию.
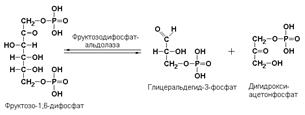
Пример:
фруктозодифосфатальдолаза (фруктозо-1,6-дифосфат-D-глицеральдегид-3-фосфат-лиаза, КФ 4.1.2.13) катализирует реакцию:
Подкласс 4.2составляют углерод-кислород-лиазы катализирующие разрыв связей между атомами углерода и кислорода.
В этот подкласс входят:
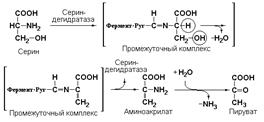
4.2.1 гидролиазы (гидратазы, дегидратазы) участвующие в реакциях дегидратации и гидратации. Примером может служить сериндегидратаза (L-серингидролиаза (дезаминирующая), КФ 4.2.1.3), катализирующая реакцию:
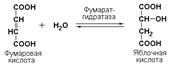
Иногда за основу рабочего названия может быть принята обратная реакция с применением термина «гидратаза». Так, для фермента цикла трикарбоновых кислот L-малатгидролиазы (КФ 4.2.1.2) рекомендовано название фумаратгидратаза:
Подкласс 4.3объединяет углерод-азот лиазы, катализирующие расщепление или образование связей С—N.
Подкласс представлен в основном аммиак-лиазами – ферментами, обеспечивающими дезаминирование аминокислот с отщеплением аммиака, что приводит к образованию ненасыщенных углерод-содержащих соединений.
Углерод-сера лиазы, составляющие подкласс4.4 катализируют расщепление или образование связей С—S. Большинство данных ферментов в качестве кофермента используют пиридоксальфосфат. Углерод-сера лиазы играют существенную роль в метаболизме серосодержащих аминокислот.
5 класс. Изомеразы. Изомеразы катализируют реакции изомеризации – геометрические или структурные изменения в пределах одной молекулы.
Деление на подклассы зависит от типа катализируемой реакции изомеризации:
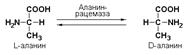
Подкласс 5.1представлен рацемазами и эпимеразами, которые катализируют взаимопревращения изомеров, содержащих асимметрические атомы углерода. Рацемазами называются ферменты, действующие на субстраты с одним асимметрическим атомом углерода, например, превращающие L-аминокислоты в D-аминокислоты. Одним из таких ферментов является aлaнинрацемаза (аланин-рацемаза. КФ 5.1.1.1), катализирующая реакцию:
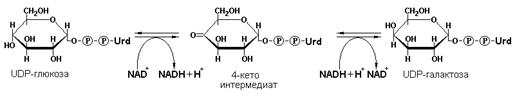
Эпимеразами называются ферменты, действующие на субстраты с несколькими асимметрическими атомами углерода. К таким ферментам относится NAD+-зависимая галактозо-4-эпимераза, (УДФ-галактозо-4-эпимераза, КФ 5.1.3.2), превращающая аксиальную гидроксильную группу у С-4 атома углерода галактозы в экваториальную гидроксильную группу глюкозы в процессе эпимеризации этих двух сахаров:
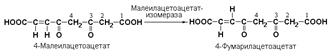
Подкласс 5.2включает цис-транс-изомеразы – ферменты, вызывающие изменение геометрической конфигурации относительно двойной связи. Примером такого фермента является малеилацетоацетатизомераза (малеилацетоацетат-цис-транс-изомераза, КФ 5.2.1.2), превращающая малеилацетоацетат в фумарилацетоацетат:
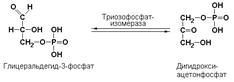
Подкласс 5.3объединяет специфические изомеразы, часто называемые внутримолекулярными оксидоредуктазами, которые катализируют взаимопревращения альдоз и кетоз. При этом происходит окисление СН-ОН-группы с одновременным восстановлением соседней С=О-группы. Так, например, триозофосфатизомераза (D-глицеральдегид-3-фосфат-кетол-изомераза, КФ 5.3.1.1) катализирует одну из важнейших реакций изомеризации в ходе гликолитического распада глюкозы:
К изомеразам относятся также внутримолекулярные трансферазы, осуществляющие перенос одной группы с одной части молекулы субстрата на другую часть той же молекулы (мутазы), и внутримолекулярные лиазы, катализирующие реакции дециклизации, а также реакции превращения одного типа кольца в другой.
6 класс. Лигазы. Лигазы катализируют образование органических соединений из активированных нуклеозидтрифосфатами (АТР, GTP, UTP, или CTP) исходных веществ. Для ферментов этого класса сохраняется также тривиальное название синтетазы. Общая схема реакции:
А + В + АТР → А—В + АDP + Н3РО4
Разделение лигаз на подклассы связано с типом образуемой связи.
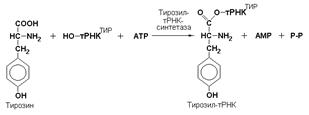
Ферменты подкласса 6.1образуют связи углерод-кислород (С—О). К ним относится группа ферментов, известных как аминоацил-тРНК-лигазы (аминоацил-тРНК-синтетазы), которые катализируют реакции связывания аминокислот с соответствующими транспортными РНК. В этих реакциях образуются активированные формы аминокислот, способные участвовать в процессе синтеза белка на рибосомах. Примером таких ферментов может служить тирозил-тРНК-синтетаза (L-тирозин: тРНК-лигаза (АМР), КФ 6.1.1.1), участвующая в реакции активирования тирозина:
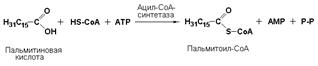
Лигазы подкласса 6.2 образуют связи углерод-сера (С—S). Этот подкласс представлен в первую очередь ферментами, катализирующими образование тиоэфиров жирных кислот с коэнзимом А. При их участии синтезируются различные ацил-СоА – активированные формы жирных кислот, способные вступать в различные реакции биосинтеза и распада. Например, ацил-СоА-синтетаза (карбоновая кислота: коэнзим А-лигаза (АМР), КФ 6.2.1.2) активирует пальмитиновую кислоту в следующей реакции:
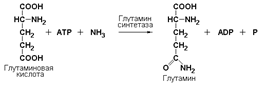
Лигазы подкласса 6.3образуют связи углерод-азот (С—N). Ферменты катализируют многочисленные реакции введения азотсодержащих групп в органические соединения. Примером может служить глутаминсинтетаза (L-глутамин: аммиак-γ-лигаза (АDP), КФ 6.3.1.2), участвующая в обезвреживании токсичного продукта обмена – аммиака в реакции с глутаминовой кислотой:
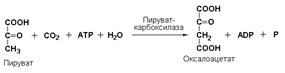
Лигазы подкласса 6.4 образуют связи углерод-углерод (С—С). Из этих ферментов наиболее изучены карбоксилазы, обеспечивающие карбоксилирование ряда соединений, в результате чего происходит удлинение углеродных цепей. Важнейшим представителем данного подкласса является пируваткарбоксилаза (пируват: СО2-лигаза (АDP), КФ 6.4.1.1), ускоряющая реакцию образования оксалоацетата – ключевого соединения цикла трикарбоновых кислот и биосинтеза углеводов:
Коферменты
Подобно другим функциональным белкам, ферменты делятся на простые (однокомпонентные) и сложные (двухкомпонентные). Простые ферменты – это белки, построенные из аминокислот, и при гидролизе распадаются только на аминокислоты. К их числу относятся, например, гидролитические ферменты (пепсин, трипсин, уреаза). Сложные ферменты – это по сути сложные белки, содержащие, кроме, полипептидной цепи, небелковый компонент. При их гидролизе образуются не только свободные аминокислоты, но и небелковый фрагмент или продукты его распада.
Белковая часть сложного фермента получила название апофермента, небелковая часть – кофактора. Кофакторы могут иметь разную химическую природу и отличаться по прочности связи с апоферментом. Если кофактор прочно связан с апоферментом ковалентной связью, он называется простетической группой (FAD, FMN, биотин, пиридоксаль-5'-фосфат липоевая кислота). Простетическая группа обычно остаётся в составе фермента на всех стадиях каталитической реакции. Кофактор, который легко отделяется от апофермента и способен к самостоятельному существованию, называется коферментом. Апофермент удерживает кофермент нековалентными связями – водородными, электростатическими и др. Обычно кофермент связывается с апоферментом только во время катализа, после окончания реакции он покидает активный центр. Такими легко диссоциирующими коферментами являются коферменты-переносчики, действие которых связано с переходом от одной молекулы фермента к другой. Некоторые коферменты, например NAD, в зависимости от каталитических реакций, в которых они участвуют, могут функционировать как простетическая группа или покидать активный центр фермента.
Кофермент вместе с апоферментом образуют холофермент:
Кофермент + Апофермент ↔ Холофермент
Следует отметить одну отличительную особенность сложных ферментов, заключающуюся в том, что ни кофактор (в том числе кофермент), ни сам по себе апофермент каталитической активностью не обладают и только их объединение в единое целое обеспечивает быстрое протекание химической реакции.
