Спирты, альдегиды, кетоны
Цель работы: изучить понятия «спирты», «альдегиды», «кетоны» и свойства этих соединений.
Задание: выполнить химический эксперимент по установлению свойств важнейших представителей спиртов, альдегидов и кетонов. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Спирты– это производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильные группы −ОН.
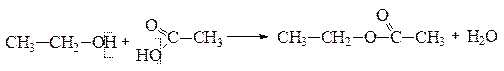 Химические свойства спиртов определяются гидроксильной группой −ОН, входящей в состав молекулы. Химические реакции спиртов могут проте-
Химические свойства спиртов определяются гидроксильной группой −ОН, входящей в состав молекулы. Химические реакции спиртов могут проте-
кать с участием всей группы (с разрывом связи С−О) или идти по водороду гидроксильной группы (с разрывом связи О−Н), например реакция этерификации:
уксусноэтиловый эфир (этилацетат)
Фенолы – это органические соединения, в которых гидроксильная группа соединена непосредственно с атомом углерода бензольного кольца. Простейшим представителем фенолов является гидроксибензол или фенол, имеющий одну гидроксильную группу в бензольном кольце:
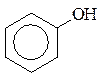 |
или С6Н5−ОН
Фенол – твердое кристаллическое вещество с характерным запахом, плохо растворяющееся в воде. Химические свойства фенолов определяются гидроксильной группой и связанным с ней бензольным кольцом.
Кислотные свойства. Фенолы проявляют кислотные свойства и взаимодействуют со щелочными металлами и щелочами:
2C6H5OH + 2Na → 2C6H5ONa + H2;
C6H5OH + NaOH → C6H5ONa + H2O.
Реакции замещения в бензольном кольце. Гидроксильная группа оказывает очень большое влияние на бензольное кольцо, увеличивая его реакционную способность. Поэтому фенол легко вступает в реакции электрофильного замещения (с ориентацией заместителей в о- и п-положения). Например, он легко бромируется бромной водой с образованием 2,4,6-трибромфенола.
Качественная реакция на фенол. Фенол образует с FeCl3 комплексную соль, окрашенную в фиолетовый цвет.
Под действием окислителей (K2Cr2O7, KMnO4) в присутствии H2SO4 спирты окисляются с образованием альдегидов и кетонов, например:
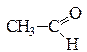 |
3С2H5OH + K2Cr2O7 + 4H2SO4 → Cr2(SO)3 + K2SO4 + 3 + 7Н2О
уксусный альдегид
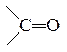 |
Альдегиды и кетоны содержат в молекуле карбонильную группу
В молекулах альдегидов карбонильная группа соединена с углеводородным радикалом и атомом водорода. Первым членом гомологического ряда аль-
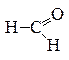 |
дегидов является метаналь
формальдегид
40 %-ный водный раствор формальдегида называется формалином.
В молекулах кетонов карбонильная группа соединена с двумя разными R−CO−R′ или одинаковыми радикалами. Например,
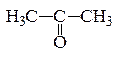 |
ацетон
По своим химическим свойствам альдегиды являются восстановителями, которые легко окисляются в кислоты. Например, при окислении альдегидов аммиачным раствором оксида серебра образуется карбоновая кислота и происходит выделение металлического серебра. Оно тонким блестящим слоем покрывает стенки сосуда, в котором проводилась реакция, поэтому данная реакция называется «реакцией серебряного зеркала» и является качественной на альдегиды:
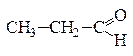 | |||
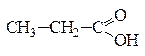 | |||
+ 2[Ag(NH3)2]OH → + 2Ag↓ + 4NH3 + H2O.
пропаналь пропановая кислота
Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При этом происходит разрыв углеродной цепи и образование смеси продуктов. Кетоны не вступают в реакцию серебряного зеркала.
Выполнение работы
Опыт 1. Окисление спирта в альдегид
Налить в пробирку 2–3 мл раствора К2Cr2O7, 1–2 мл разбавленной серной кислоты и прилить по каплям примерно 0,5–1 мл этилового спирта. Обратить внимание на характерный запах выделяющегося в газообразном состоянии уксусного альдегида и изменение оранжевой окраски раствора на зеленую.
Требование к результату опыта
Закончить уравнение реакции К2Cr2O7+ Н2SO4 + C2H5OH → ….
Опыт 2. Получение уксусноэтилового эфира
Налить в пробирку 1–2 мл этилового спирта и затем осторожно такой же объем концентрированной серной кислоты. Туда же прибавить немного сухого уксуснокислого натрия, слегка нагреть пробирку и понюхать запах образовавшегося вещества.
Требование к результату опыта
Составить уравнение реакции образования уксусноэтилового эфира.
Опыт 3. Фенол и его свойства
· (Проводить в вытяжном шкафу!). Поместить в пробирку несколько кристалликов фенола и постепенно приливать туда же раствор NaOH, пока при встряхивании пробирки фенол не растворится. К образовавшемусю раствору фенолята натрия прилить раствор серной кислоты. Наблюдать появление мути и выпадение в осадок слабо растворимого в воде фенола.
· Налить в пробирку 1–2 мл водного раствора фенола и добавить туда же несколько капель бромной воды. При встряхивании пробирки быстро образуется белый осадок трибромфенола.
· Налить в пробирку 3–4 мл водного раствора фенола и добавить туда же 1–2 капли раствора хлорного железа. Наблюдать появление фиолетового окрашивания.
Требование к результатам опыта
Составить уравнения реакций: образования фенолята натрия; взаимодействия фенолята натрия с серной кислотой; образования трибромфенола.
Опыт 4. Восстановительные свойства альдегидов
В химический стакан налить (до половины его объема) воды и нагреть ее до кипения. В пробирку, предворительно тщательно промытую раствором щелочи и дистиллированной водой, налить 2–3 мл 2 %-го раствора нитрата серебра AgNО3 и к нему добавить по каплям 1 %-й раствор аммиака до тех пор, пока выпадающий сначала осадок Ag2О полностью не растворится. При этом образуются комплексные ионы [Ag(NH3)2]+.
В раствор комплексной соли серебра прилить при помощи пипетки (осторожно по стенке) 2–3 капли формалина и поместить пробирку в стакан с кипящей водой. Через некоторое время стенки пробирки покроются блестящим налетом металлического серебра.
Требование к результату опыта
Закончить уравнение реакции HCOH + [Ag(NH3)2]OH → ….
Опыт 5. Окисление ацетона
Налить в пробирку 6–8 капель ацетона, добавить равный объем дистиллированной воды, несколько капель 2 М раствора серной кислоты и осторожно нагреть на водяной бане до 50–60 °С. Добавить раствор KMnO4, слегка встряхивая пробирку, до тех пор, пока прекратится обесцвечивание перманганата.
Требование к результату опыта
Написать уравнение реакции окисления ацетона перманганатом калия, учитывая, что при этом происходит распад молекулы и образуется смесь муравьиной и уксусной кислот.
Примеры решения задач
Пример 29.1.Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
С2Н4 → Х → Y → С2Н5−О−С2Н5.
Указать условия протекания реакций. Назвать вещества Х и Y.
Решение. Конечный продукт – диэтиловый эфир – получается из этилового спирта, следовательно, вещество Y – этанол. Перейти от этилена к этанолу можно через промежуточное соединение – галогенопроизводное этана (вещество Х).
При взаимодействии этилена с бромоводородом образуется бромэтан:
C2H4 + HBr → C2H5Br.
Бромэтан гидролизуется до спирта действием водного раствора NaOH:
C2H5Br + NaOH → C2H5OH + NaBr.
При нагревании этанола до 140 °С в присутствии серной кислоты в качестве катализатора образуется диэтиловый эфир:
C2H5OH 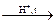 С2Н5−О−С2Н5 + H2O.
С2Н5−О−С2Н5 + H2O.
Пример 29.2. Какая масса пропилата натрия может быть получена при взаимодействии 15 г пропанола-1 с 9,2 г натрия?
Решение. Записываем уравнение реакции между пропанолом-1 и металлическим натрием:
2CH3−СH2−СН2−OH + 2Na → 2CH3−СH2−СН2−ONa + H2.
Определяем количества вещества пропанола-1 и натрия:
υ (С3Н7ОН) = 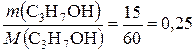 моль;
моль;
υ (Na) = 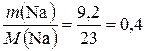 моль.
моль.
Из уравнения реакции следует, что число моль спирта и натрия должны быть равны, следовательно, натрий взят в избытке.
На основании уравнения реакции записываем:
υ (C3H7ONa) = υ(C3H7OH); υ (C3H7ONa) = 0,25 моль.
Определяем массу пропилата натрия, которую можно получить:
m (C3H7ONa) = υ(C3H7ONa) ∙ M(C3H7ONa);
m (C3H7ONa) = 0,25 ∙ 82 = 20,5 г.
Пример 29.3. Формалин представляет собой 40 %-ный водный раствор формальдегида. Рассчитать массу метанола, которую необходимо окислить для получения 600 г формалина.
Решение. Вычисляем массу формальдегида, который потребуется для приготовления формалина:
m (CH2O) = 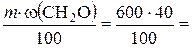 240 г.
240 г.
Количество вещества требуемого формальдегида равно
υ (CH2O) = 
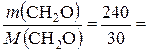 8 моль.
8 моль.
Составляем уравнение реакции окисления метанола:
CH3OH + [O] → CH2O + H2O.
Из уравнения реакции следует, что υ (CH3OH) = υ(CH2O); υ(CH2O) = 8 моль.
Масса требуемого метанола равна
m (CH3OH) = υ(CH3OH) ∙ M (CH3OH);
m (CH3OH) = 8 ∙ 32 = 256 г.
