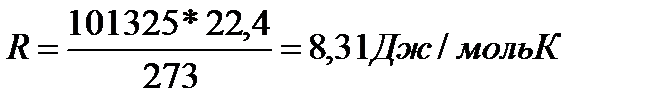Тема 5.2. Агрегатные состояния вещества
Агрегатные состояния веществ. Их общая характеристика. Газообразное состояние веществ. Идеальные газы. Основные законы идеального газа. Реальные газы. Критическое состояние. Изотерма реального газа. Сжижение газов, значение и применение этого явления. Замораживание пищевых продуктов. Влияние содержание CO2 и О2 и др. газовых сред на хранение плодов.
Жидкое состояние вещества. Свойства жидкостей: изотропность, внутреннее строение, ассоциация. Поверхностное натяжение. Свободная поверхностная энергия. Поверхностно-активные вещества, их роль в технологии приготовления пищи. Измерение поверхностного натяжения. Вязкость жидкостей, ее зависимость от различных факторов. Относительная вязкость. Изменение вязкости. Влияние вязкости на качество и вкусовые свойства пищевых продуктов: супов, студней, каш, пюре, желированных блюд, изделий из теста.
Твёрдое состояние вещества. Кристаллическое и аморфное состояние. Свойства: анизотропия и изотропность. Типы кристаллических решеток. Образование и разрушение кристаллов, сублимация, её значение в консервировании пищевых продуктов.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Обратите внимание на то, что, в результате изменения расстояния между частицами и сил взаимодействия между ними вещество может находиться в твердом, жидком или газообразном состоянии. Агрегатное состояние вещества зависит от температуры и давления. При переходе вещества из одного состояния в другое меняются расстояния между молекулами и силами межмолекулярного взаимодействия. Но не все вещества могут находиться во всех трех агрегатных состояниях. Для некоторых возможно только одно или два агрегатных состояния, например, крахмал, находится только в твердом, а жир - в жидком и твердом состояниях. Другие вещества при определенных условиях могут находиться одновременно в двух или даже в трех агрегатных состояниях. Так вода при давлении 610,6Па и температуре 0,01С° находится в устойчивом равновесии в трех состояниях; твердом (лёд), жидком (жидкая вода), и газообразном (водяной пар), что можно записать как: лед - вода - пар.
Переходя к характеристике газообразного состояния, повторите понятие об идеальном газе, свойства которого определяются температурой и давлением, при которых он находиться в данный момент. Рассматривая законы идеальных газов, обратите особое внимание на опытные данные, формулировки, математическое и графическое выражение законов Бойля - Мариотта, Шарля, Гей-Люссака, Авогадро. Расчетное уравнение для приведения газов к нормальным условиям имеет следующий вид:
( 1 )
Важно помнить, что данное уравнение (1) обобщает газовые законы Бойля-Мариотта, Шарля, Гей-Люссака и используется при решении задач (с.220-221 учебника). Поскольку p0, V0 , T0 уравнение (1) - величины постоянные, то отношение 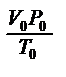 есть также величина постоянная для всех газов, независимо от их химической природы. Ее обозначают буквой R и называют молярной газовой постоянной. С учетом этого уравнение (1) преобразуется:
есть также величина постоянная для всех газов, независимо от их химической природы. Ее обозначают буквой R и называют молярной газовой постоянной. С учетом этого уравнение (1) преобразуется:

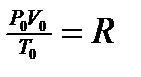 или
или 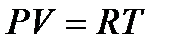 ( 2 )
( 2 )
Уравнение (2) справедливо для 1 моля газа. Если в объеме газа будет содержаться «n» молей, то уравнение будет иметь общий вид:
PV = nRT ( 3 )
Уравнение (3) является уравнением состояния идеального газа и называется уравнением Менделеева-Клапейрона.
Число молей «n» можно рассчитать по формуле: 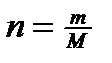 где m – масса газа (кг), содержащегося в объеме V при давлении P, и температуре Т.
где m – масса газа (кг), содержащегося в объеме V при давлении P, и температуре Т.
Подставив значение «n» в уравнение (3), получим уравнение для вычисления М 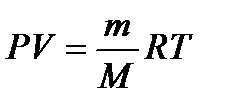 (4) откуда
(4) откуда 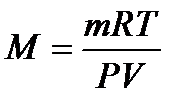 (5)
(5)
В единицах системы СИ: Р0 = 101325 н/м2 (105 Па), V0 = 22,4 м3, Т0 = 273О К.